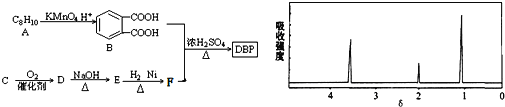
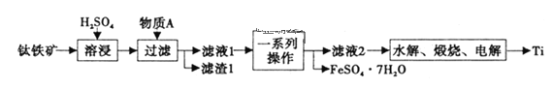
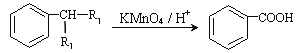题目内容
【题目】肉桂酸(M)是医药、香料的中间体,实验室由芳香化合物A制备M的一种合成路线如下:
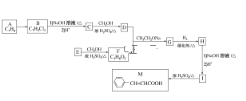
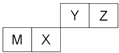
已知:①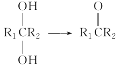 (R1、R2表示氢原子或烃基)
(R1、R2表示氢原子或烃基)
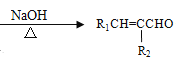
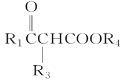
②R1COOR2+R3CH2COOR4![]()
 +R2OH
+R2OH
(R1、R3表示氢原子或烃基,R2、R4表示烃基)
请回答下列问题:(1)A→B的条件为________。
(2)E中所含官能团的名称为________。
(3)H的结构简式为________。(4)I→M的反应类型为________。
(5)D+F→G的化学方程式为________________________。
(6)同时满足下列条件的I的同分异构体有________种(不考虑立体异构),任写一种核磁共振氢谱中有6组吸收峰且峰面积之比为1:2:2:2:2:1的结构简式为_______。
①能发生显色反应和银镜反应 ②苯环上连有两个取代基
(7)参照上述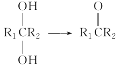 信息,以甲烷和苯酚为原料(其他无机试剂任选),设计制备
信息,以甲烷和苯酚为原料(其他无机试剂任选),设计制备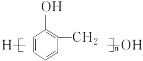 的合成路线_______________________。
的合成路线_______________________。
【答案】光照 羧基 ![]() 消去反应
消去反应 ![]() +CH3COOCH3
+CH3COOCH3![]()
 +CH3OH 30
+CH3OH 30 ![]()
![]()
![]() CH4
CH4![]() CH2Cl2
CH2Cl2![]() HCHO
HCHO
【解析】
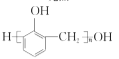
根据M结构简式知A含苯环,结合A分子式知,A为![]() ,A发生取代反应生成B,B发生水解反应然后酸化得到C,C能和乙醇发生酯化反应,则C为羧酸,所以A中甲基上两个H原子被取代生成B, B为
,A发生取代反应生成B,B发生水解反应然后酸化得到C,C能和乙醇发生酯化反应,则C为羧酸,所以A中甲基上两个H原子被取代生成B, B为![]() ,C为
,C为![]() ,D为
,D为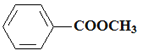 ; E和甲醇发生酯化反应生成F,根据F分子式知,E为CH3COOH,F为CH3COOCH3,DF发生信息②的反应生成G为
; E和甲醇发生酯化反应生成F,根据F分子式知,E为CH3COOH,F为CH3COOCH3,DF发生信息②的反应生成G为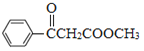 ,G发生加成反应生成H为
,G发生加成反应生成H为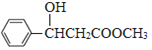 ,H水解酸化得到I为
,H水解酸化得到I为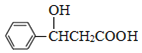 ,I发生消去反应生成M;
,I发生消去反应生成M;
(7)以甲烷和苯酚为原料(其他无机试剂任选)制备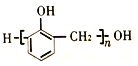 ,
,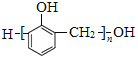 可以由HCHO和
可以由HCHO和![]() 发生缩聚反应得到,HCHO可以由CH2Cl2水解得到,CH2Cl2可以由CH4发生取代反应得到。
发生缩聚反应得到,HCHO可以由CH2Cl2水解得到,CH2Cl2可以由CH4发生取代反应得到。
(1)A→B为甲苯上甲基的取代反应,Cl2在光照条件下反应即可进行;
(2
(3)H的结构简式为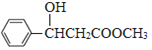 ;
;
(4)I→M为醇的消去反应,所以该的反应类型为消去反应;
(5)D+F→G的化学方程式为![]() +CH3COOCH3
+CH3COOCH3![]()
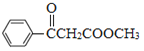 +CH3OH;
+CH3OH;
(6)I为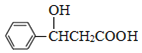 ,I的同分异构体符合下列条件:
,I的同分异构体符合下列条件:
①能发生显色反应和银镜反应,说明含有酚羟基和醛基;
②苯环上连有两个取代基,其中一个取代基为酚羟基;取代基如果为HCOOCH2CH2-,有3种;取代基为HCOOCH(CH3)-,有3种;取代基为-CH(OH)CH2CHO,有3种;取代基为-CH2CHOHCHO,有3种;取代基为-COH(CH3)CHO,有3种,取代基为-OCH2CH2CHO,有3种;取代基为-OCH(CH3)CHO,有3种;取代基为-CH2-OCH2CHO,有3种;取代基为-CH2CH2-O-CHO,有3种;取代基为-CH(OCH3)CHO,有3种;所以符合条件的有30种;一种核磁共振氢谱中有6组吸收峰目峰面积之比为1:2:2:2:2:1的结构简式为![]() 或
或![]() 或
或![]() ;
;
(7)以甲烷和苯酚为原料(其他无机试剂任选)制备 ,
, 可以由HCHO和
可以由HCHO和![]() 发生缩聚反应得到,HCHO可以由CH2Cl2水解得到,CH2Cl2可以由CH4发生取代反应得到,其合成路线为
发生缩聚反应得到,HCHO可以由CH2Cl2水解得到,CH2Cl2可以由CH4发生取代反应得到,其合成路线为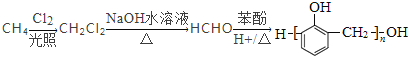 。
。

【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)![]() CH4(g)+C3H6(g),请回答下列问题:
CH4(g)+C3H6(g),请回答下列问题:
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25 ℃、101 kPa几种有机物的生成热如下表所示:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ· mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_____________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
下列情况能说明该反应达到平衡状态的是________(填标号)。
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率和乙烷消耗速率相等
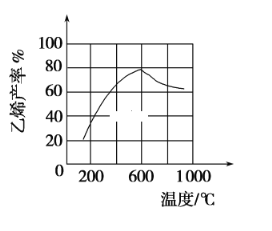
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________。
(4)在一定温度下向10 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)=________ mol·L-1·min-1。
②上述条件下,正丁烷的平衡转化率为_______,该反应的平衡常数K为_____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-===26CO32-,则负极反应式为_________________________。
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
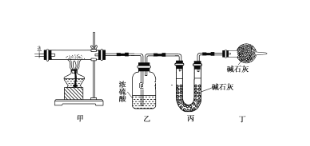
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中________________(填现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
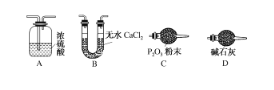
(2)步骤④中缓缓通入空气数分钟的目的是___________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的____________(填字母)连接在________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
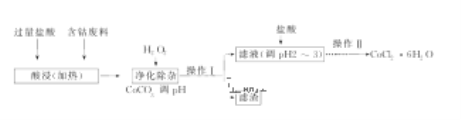
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂质时,加入H2O2发生反应的离子方程式为___________________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整pH为2~3的目的为________________________________。