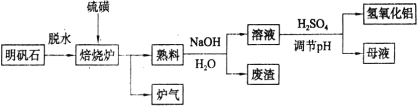
题目内容
【题目】在273K和101kPa的条件下,将2.00g氦气,1.40g氮气和1.60g氧气混合,求:
(1)该混合气体的总物质的量为______________
(2)该混合气体的体积是_______________
(3)该混合气体的平均摩尔质量为_________
【答案】0.6 13.44 8.3
【解析】
(1)分别计算氦气、氮气和氧气的物质的量可得;
(2)依据气体摩尔体积计算可得;
(3)依据摩尔质量公式计算可得。
(1)2.00g氦气的物质的量为![]() =0.5mol,1.40g氮气的物质的量为
=0.5mol,1.40g氮气的物质的量为![]() =0.05mol,1.60g氧气的物质的量为
=0.05mol,1.60g氧气的物质的量为![]() =0.05mol,则混合气体的总物质的量为(0.5+0.05+0.05)mol=0.6mol,故答案为:0.6;
=0.05mol,则混合气体的总物质的量为(0.5+0.05+0.05)mol=0.6mol,故答案为:0.6;
(2)在273K和101kPa的条件下,混合气体的体积为n×Vm=0.6mol×22.4L/mol=13.44L,故答案为:13.44;
(3)混合气体的总质量为(2.00+1.40+1.60)g=5.00g,混合气体的总物质的量为0.6mol,则该混合气体的平均摩尔质量为![]() =8.3g/mol,故答案为:8.3。
=8.3g/mol,故答案为:8.3。

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目