题目内容
【题目】A、B、C、D为原子序数依次增大的前四周期元素。BA3能使湿润的红色石蕊试纸变蓝,A、B、C三种原子的电子数之和等于25,D有两种常见氧化物,其中一种颜色是砖红色的。
请回答下列问题:
(1)以上四种元素中,电负性最小的是____(填元素符号);
(2)在BA3、AC中,沸点较高的是____(填化学式),其原因是_____。
(3)B元素组成的常见单质中σ键和π键的个数比是____,D的基态原子的外围电子排布式为______。
(4)化合物BA3的立体构型为_____,其中心原子的杂化轨道类型为_______。
(5)由B、D形成的晶体的晶胞图所示,己知紧邻的B原子与D原子距离为acm。
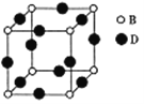
①该晶胞化学式为_____。
②该晶体的密度为_____gcm-3(用含a、NA的代数式表示,设NA为阿伏加德罗常数值)。
【答案】Cu NH3 NH3分子之间存在氢键 1:2 3d104s1 三角锥形 sp3 Cu3N ![]()
【解析】
BA3能使湿润的红色石蕊试纸变蓝,A是H元素、B是N元素;A、B、C三种原子的电子数之和等于25,则C的电子数是17,C是Cl元素;D有两种常见氧化物,其中一种颜色是砖红色的,D是Cu元素。
(1)金属性越强的元素电负性越小,非金属性越强的元素电负性越大,H、N、Cl、Cu四种元素中,只有Cu是金属,所以电负性最小的是Cu;
(2)NH3可以形成分子间氢键,所以在NH3、HCl中,沸点较高的是NH3。
(3)N2中存在N![]() N,叁键中有1个 σ键和2个π键,σ键和π键个数比是1:2,Cu原子核外有29个电子,基态原子核外电子排布式是1s22s22p63s23p63d104s1,外围电子排布式为3d104s1。
N,叁键中有1个 σ键和2个π键,σ键和π键个数比是1:2,Cu原子核外有29个电子,基态原子核外电子排布式是1s22s22p63s23p63d104s1,外围电子排布式为3d104s1。
(4)NH3中N原子的杂化轨道数是![]() ,N原子杂化轨道类型为sp3,有1个孤电子对,分子立体构型为三角锥形。
,N原子杂化轨道类型为sp3,有1个孤电子对,分子立体构型为三角锥形。
(5)①根据均摊原则,晶胞中N原子数是![]() 、Cu原子数是
、Cu原子数是![]() ,该晶胞化学式为Cu3N。
,该晶胞化学式为Cu3N。
②晶胞的化学式是Cu3N,摩尔质量是206g/mol,紧邻的N原子与Cu原子距离为acm,晶胞的边长是2acm,晶胞他就是![]() 。该晶体的密度为
。该晶体的密度为![]()
![]() gcm-3。
gcm-3。