题目内容
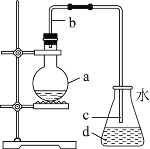
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子 质量 | 溶解性 |
苯甲醛 | 178.1 | 1.045 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.045 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |

实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.1mL(约3.24g)苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到1.908g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号)。


(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
【答案】球形冷凝管 使物质充分混合 ![]() + NaClO→
+ NaClO→![]() + NaCl+H2O 防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 ③ 178.1℃ 60.0%
+ NaCl+H2O 防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 ③ 178.1℃ 60.0%
【解析】
苯甲醇与稍过量的次氯酸钠溶液反应生成苯甲醛、氯化钠和水,反应过程中不断搅拌使其充分反应,反应后利用苯甲醛微溶于水,易溶于有机物的性质,用二氯甲烷萃取水相中的苯甲醛等有机物,合并后用无水硫酸镁干燥,得到有机混合物,再蒸馏得到苯甲醛。
⑴根据实验装置得出仪器b的名称为球形冷凝管,搅拌器的作用是使物质充分混合;故答案为:球形冷凝管;使物质充分混合。
⑵苯甲醇与NaClO反应生成苯甲醛、氯化钠和水,其反应的化学方程式为![]() + NaClO→
+ NaClO→![]() + NaCl+H2O;故答案为:
+ NaCl+H2O;故答案为:![]() + NaClO→
+ NaClO→![]() + NaCl+H2O。
+ NaCl+H2O。
⑶步骤①中,投料时,次氯酸钠具有强氧化性,易将苯甲醛氧化,因此次氯酸钠不能过量太多,原因是防止苯甲醛被氧化为苯甲酸,使产品的纯度降低;步骤③中加入无水硫酸镁主要作用是吸收水份,干燥有机物,若省略该操作,可能造成的后果是产品中混有水,纯度降低;故答案为:防止苯甲醛被氧化为苯甲酸,使产品的纯度降低;产品中混有水,纯度降低。
⑷步骤②中,用二氯甲烷萃取水相中的有机物,溶液分层,用分液漏斗分离;故答案为:③。
⑸步骤④中,根据题意苯甲醛的178.1℃,因此蒸馏温度应控制在178.1℃左右;故答案为:178.1℃。
⑹根据![]() ~
~ ![]() 关系式,3.24g苯甲醇上得到苯甲醛的质量为
关系式,3.24g苯甲醇上得到苯甲醛的质量为![]() ,苯甲醛的产率为
,苯甲醛的产率为![]() ;故答案为:60.0%。
;故答案为:60.0%。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验用所给实验装置可达到目的的是( )

选项 | 反应原理 |
A |
|
B | CH3COOH+(CH3)2CHCH2CH2OH |
C |
|
D | CH3CH2CH2CH2OH |
A.AB.BC.CD.D