题目内容
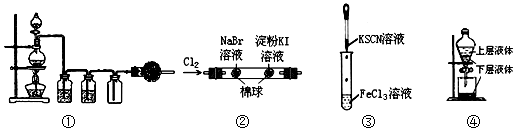
(14分) 下面是实验室中制氯气的装置:
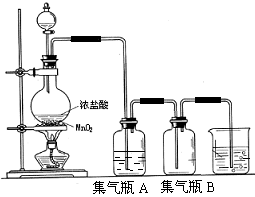
试回答下列问题:
(1)写出制氯气的化学方程式 。
(2)集气瓶A中盛装的是饱和食盐水其作用是 。
(3)在A和B装置中还应加一个装置,作用是什么 。
(4)检验氯气的试纸? ,写出该反应的化学方程式 。
(5)烧杯里装的是 ,反应的离子方程式: 。

试回答下列问题:
(1)写出制氯气的化学方程式 。
(2)集气瓶A中盛装的是饱和食盐水其作用是 。
(3)在A和B装置中还应加一个装置,作用是什么 。
(4)检验氯气的试纸? ,写出该反应的化学方程式 。
(5)烧杯里装的是 ,反应的离子方程式: 。
(1)MnO2+4HCl=MnCl2+Cl2+2H2O
(2)除去氯气中的氯化氢气体
(3)除去水蒸气
(4)湿润的碘化钾淀粉试纸Cl2+2KI=2KCl+I2
(5)氢氧化钠溶液 Cl2+2OH-=Cl-+ClO-+H2O
(2)除去氯气中的氯化氢气体
(3)除去水蒸气
(4)湿润的碘化钾淀粉试纸Cl2+2KI=2KCl+I2
(5)氢氧化钠溶液 Cl2+2OH-=Cl-+ClO-+H2O
略

练习册系列答案
相关题目