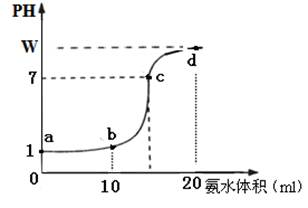
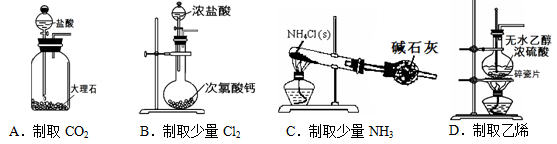
题目内容
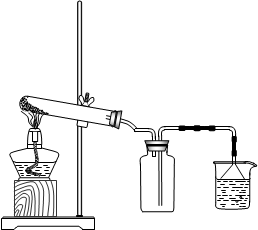
为检验炭粉与浓硫酸反应的产物设计如下装置,回答相关问题:
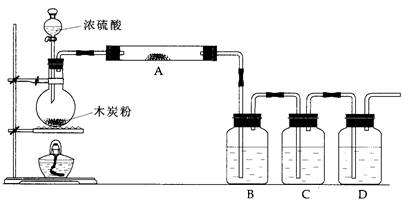
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用
A中加入的试剂和作用是______ _____
B中加入的试剂和作用是____ ____________
D中加入的试剂和作用是__ ___________
(4)实验时,C中应观察到的现象是______________________

(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用
A中加入的试剂和作用是______ _____
B中加入的试剂和作用是____ ____________
D中加入的试剂和作用是__ ___________
(4)实验时,C中应观察到的现象是______________________
(1)反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出
(2)2H2SO4(浓)+ C ="=" 2H2O + 2SO2↑+ CO2 ↑
(3)A:无水硫酸铜。检验水
B:品红溶液。检验二氧化硫
D:澄清石灰水。检验二氧化碳
(4)酸性高锰酸钾溶液的颜色不褪尽
(2)2H2SO4(浓)+ C ="=" 2H2O + 2SO2↑+ CO2 ↑
(3)A:无水硫酸铜。检验水
B:品红溶液。检验二氧化硫
D:澄清石灰水。检验二氧化碳
(4)酸性高锰酸钾溶液的颜色不褪尽
考查物质的检验等基本实验操作
(1)由于本实验系统仪器较多,故可用小火加热烧瓶,观察B、C、D瓶中有无气泡冒出即可检验其气密性
(2)C + 2H2SO4(浓)="=" 2H2O + 2SO2↑+ CO2 ↑
(3)H2O、SO2、CO2三产物一般用无水硫酸铜、品红溶液、澄清石灰水来检验它们的存在;为了防止后二者检验时混入水气,一般先检验水,故A中加入的试剂是无水硫酸铜
SO2、CO2两氧化物均为非金属酸性氧化物,性质相似(均可使澄清石灰水变浑),但前者的还原性较强,故一般是先检验前者的存在并且吸收除去后再检验后者。
故装置B中盛装品红溶液,通过褪色来检验SO2的存在,再在装置C中盛装酸性高锰酸钾溶液来吸收SO2;
装置D中盛放澄清石灰水,来检验CO2的存在
本题的一个关键是:酸性高锰酸钾溶液必须将SO2全部吸收,它的颜色不能褪尽
(1)由于本实验系统仪器较多,故可用小火加热烧瓶,观察B、C、D瓶中有无气泡冒出即可检验其气密性
(2)C + 2H2SO4(浓)="=" 2H2O + 2SO2↑+ CO2 ↑
(3)H2O、SO2、CO2三产物一般用无水硫酸铜、品红溶液、澄清石灰水来检验它们的存在;为了防止后二者检验时混入水气,一般先检验水,故A中加入的试剂是无水硫酸铜
SO2、CO2两氧化物均为非金属酸性氧化物,性质相似(均可使澄清石灰水变浑),但前者的还原性较强,故一般是先检验前者的存在并且吸收除去后再检验后者。
故装置B中盛装品红溶液,通过褪色来检验SO2的存在,再在装置C中盛装酸性高锰酸钾溶液来吸收SO2;
装置D中盛放澄清石灰水,来检验CO2的存在
本题的一个关键是:酸性高锰酸钾溶液必须将SO2全部吸收,它的颜色不能褪尽

练习册系列答案
相关题目