题目内容
17.可逆反应2NO2(g)?2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③NO2、NO、O2的物质的量浓度比值为2:2:1
④混合气体的颜色不再改变的状态.
| A. | ①④ | B. | ②③④ | C. | ①③④ | D. | ① |
分析 ①单位时间内生成n mol O2,同时生成2n molNO2,因此v正=v逆;
②在任何时候,反应速率之比等于化学计量数之比,不能说明达到平衡状态;
③气体的物质的量大小无法判断是否达到平衡;
④混合气体的颜色不再改变,说明NO2气体的浓度不变.
解答 解:①根据单位时间内生成n molO2的同时生成2n mol NO2 ,可知生成氧气的速率和消耗速率相等,达到了平衡状态,故①正确;
②单位时间内生成n molO2的同时生成2n mol NO,都是正反应速率,无法判断是否达到平衡,故②错误;
③气体的物质的量之比无法判断正逆反应速率,故③错误;
④二氧化氮颜色不变,说明生成的二氧化氮和消耗的速率相等,达到了平衡状态,故④正确;
故选A.
点评 本题考查化学平衡状态的判断,难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.已知NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol重甲基(-CD3)含有电子数为9NA | |
| B. | 34 g H2O2中含有的阴离子数为NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA |
8.下列化学方程式书写正确的是( )
| A. | 乙醇催化氧化制取乙醛:CH3CH2OH+O2 $→_{△}^{催化剂}$ CH3CHO+H2O | |
| B. | 苯与浓硫酸、浓硝酸的混合液共热制硝基苯: | |
| C. | 乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色:5CH2=CH2+12 MnO4-+36H+→10CO2+12 Mn2++28H2O |
5.下列关于苯和甲苯说法正确的是( )
| A. | 苯和甲苯能使溴水褪色,是因为苯和甲苯均能与溴发生加成反应 | |
| B. | 苯和甲苯均可与氢气发生加成反应 | |
| C. | 苯和甲苯均可以与硝酸在一定条件下发生取代反应 | |
| D. | 苯和甲苯能使酸性高锰酸钾溶液褪色 |
12.下列有关实验叙述错误的是( )
| A. | 实验室可用硫酸铜溶液除去乙炔中的H2S等杂质气体 | |
| B. | 苯和溴水在溴化铁溶液催化作用下发生取代反应生成溴苯 | |
| C. | 只用溴水就可以将苯、四氯化碳、酒精、氢氧化钠溶液这四种物质区别开 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
2.化学与环境、生产和生活等密切相关,下列说法正确的是( )
| A. | pH小于7的雨水即为酸雨 | |
| B. | 用食醋可除去水壶内壁上的水垢 | |
| C. | 为了除去MgCl2酸性溶液的Fe3+,可在加热搅拌的条件下加入氨水 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
9.1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)=CH3CH2CH2CH3(g)△H=-236.6kJ•mol-1
CH3-C≡C-CH3(g)+2H2(g)=CH3CH2CH2CH3(g)△H=-272.7kJ•mol-1
由此不能判断( )
CH2=CH-CH=CH2(g)+2H2(g)=CH3CH2CH2CH3(g)△H=-236.6kJ•mol-1
CH3-C≡C-CH3(g)+2H2(g)=CH3CH2CH2CH3(g)△H=-272.7kJ•mol-1
由此不能判断( )
| A. | 1,3-丁二烯和2-丁炔稳定性的相对大小 | |
| B. | 1,3-丁二烯和2-丁炔分子储存能量的相对高低 | |
| C. | 1,3-丁二烯和2-丁炔相互转化的热效应 | |
| D. | 一个碳碳叁键的键能与两个碳碳双键键能之和的大小 |
6.下列实验中,不能观察到明显变化的是( )
| A. | 把一段打磨过镁带放入冷水中 | B. | 把铝条放入NaOH溶液中 | ||
| C. | 把绿豆大的钠投入到KCl溶液中 | D. | 把溴水滴加到淀粉KI溶液中 |
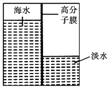 海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.
海洋是一个巨大的聚宝盆,含有丰富的矿产资源和水资源,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.