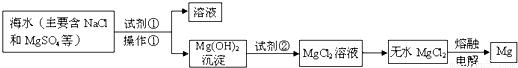
题目内容
镁及其合金是用途广泛的金属材料.从海水中提取镁的主要步骤如下:
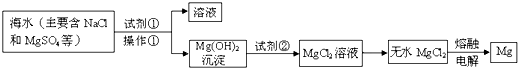
请回答:
(1)下列金属中,其冶炼方法与镁相同的是
a.Na b.Fe c.Al d.Hg
(2)若在实验室完成操作①,则需用到的玻璃仪器是
(3)试剂②与Mg(OH)2反应的离子方程式是
(4)在实验室中,检验试剂②中阴离子的操作方法和实验现象为:取少量试剂②于试管中,

请回答:
(1)下列金属中,其冶炼方法与镁相同的是
ac
ac
(填序号).a.Na b.Fe c.Al d.Hg
(2)若在实验室完成操作①,则需用到的玻璃仪器是
漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.(3)试剂②与Mg(OH)2反应的离子方程式是
Mg(OH)2+2H+=Mg2++2H2O
Mg(OH)2+2H+=Mg2++2H2O
.(4)在实验室中,检验试剂②中阴离子的操作方法和实验现象为:取少量试剂②于试管中,
加入硝酸酸化的硝酸银生成白色沉淀
加入硝酸酸化的硝酸银生成白色沉淀
,则证明试剂②中含有该阴离子.分析:(1)依据金属冶炼的原理和方法分析判断,热分解法:运用于不活泼的金属,如汞可用氧化汞加热制得.;热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原.如制钨用氢气或铝(铝热反应,在制取一些熔点高的金属是可以用这个方法)制铁用焦炭;电解法:电解法冶金会消耗大量的电能成本较高,但冶炼的金属纯度高一般用于金属的精炼.适用于K,Ca,Na,Mg,Al等活泼金属.;其他方法:CuSO4+Fe═Cu+FeSO4Na+KCl═K+NaCl(反应条件是高温,真空)(原理是高沸点金属制低沸点金属)
(2)①步骤是分离出氢氧化镁沉淀,利用过滤操作,用到的玻璃仪器为:漏斗、烧杯、玻璃棒;
(3)试剂②为盐酸与Mg(OH)2反应生成氯化镁和水;
(4)检验试剂②中阴离子是检验氯离子,试剂是硝酸酸化的硝酸银,产生白色沉淀证明;
(2)①步骤是分离出氢氧化镁沉淀,利用过滤操作,用到的玻璃仪器为:漏斗、烧杯、玻璃棒;
(3)试剂②为盐酸与Mg(OH)2反应生成氯化镁和水;
(4)检验试剂②中阴离子是检验氯离子,试剂是硝酸酸化的硝酸银,产生白色沉淀证明;
解答:解:(1)依据金属冶炼的原理和方法,a、是利用电解熔融氯化钠制备;b、铁是利用铁的氧化物和还原剂反应生成;c、铝是电解熔融氧化铝制备;d、汞是利用热分解法制备;
故答案为:ac;
(2)①步骤是分离出氢氧化镁沉淀,利用过滤操作,用到的玻璃仪器为:漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
(3)试剂②为盐酸与Mg(OH)2反应生成氯化镁和水;离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(4)检验试剂②中阴离子是检验氯离子,试剂是硝酸酸化的硝酸银,产生白色沉淀证明;故答案为:加入硝酸酸化的硝酸银生成白色沉淀;
故答案为:ac;
(2)①步骤是分离出氢氧化镁沉淀,利用过滤操作,用到的玻璃仪器为:漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
(3)试剂②为盐酸与Mg(OH)2反应生成氯化镁和水;离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(4)检验试剂②中阴离子是检验氯离子,试剂是硝酸酸化的硝酸银,产生白色沉淀证明;故答案为:加入硝酸酸化的硝酸银生成白色沉淀;
点评:本题考查了金属冶炼的原理应用,过滤操作的掌握,物质的提纯,离子检验方法的判断,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
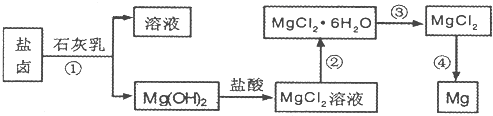
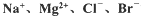 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: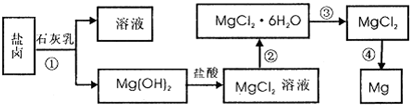
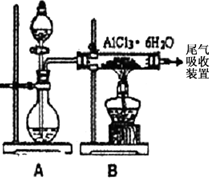

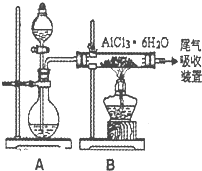
 无水AlCl3实验装置图。装置A中的两液体分别是
无水AlCl3实验装置图。装置A中的两液体分别是