题目内容
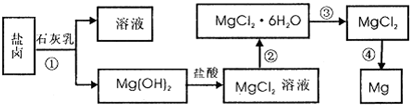
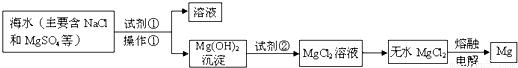
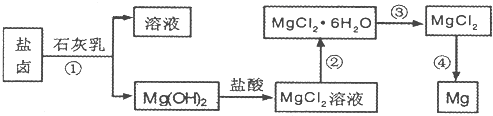
镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水中提取 的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:

(1)从转化(①得到的Mg( OH)2沉淀中混有少量的Ca( OH)2,除去少量Ca( OH)2的方法是先将沉淀加入到盛有 的烧杯中,充分搅拌后经 __ __(填操作方法)可得纯净的Mg( OH)2,在此操作过程中,玻璃棒的作用是搅拌和 .
(2)写出转化④中发生反应的化学方程式___ _。
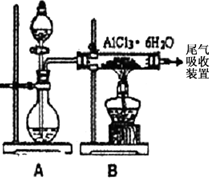
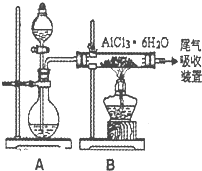
(3)已知转化③的反应原理与制取无水AlCl3相同下图是制取
 无水AlCl3实验装置图。装置A中的两液体分别是
无水AlCl3实验装置图。装置A中的两液体分别是
浓硫酸和浓盐酸。请回答:
①D为什么不直接加热来制取无水AlCl3,请用化学
方程式表示: ;
②分液漏斗中应盛装的试剂是__ __;
③由分液漏斗向烧瓶中加试剂时应注意的事项
是 。
(1)饱和MgCl2(或氯化镁)溶液(2分) 过滤 洗涤(2分) 引流(1分)
(2)MgCl2
(3)①AlCl3+3H2O
(写成AlCl3+3H2O
②浓盐酸(2分)
③控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中。(2分)

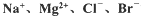 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: