题目内容
9.按要求书写方程式:(1)实验室制氨气的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)钠与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
分析 (1)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水;
(2)钠与水反应生成氢氧化钠、氢气.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)钠与水反应生成氢氧化钠、氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查了化学方程式、离子方程式的书写,明确反应实质是解题关键,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
19.下列有关能量转换的说法错误的是( )
| A. | 天然气燃烧是化学能转化为热能的过程 | |
| B. | 二次电池充电的过程是电能转化为化学能的过程 | |
| C. | 燃煤发电是从煤中的化学能经过一系列能量转换最终转化为电能的过程 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变为热能的过程 |
20.控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )

| A. | 反应开始时,甲中石墨电极上Fe3+被还原 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 平衡时甲中溶入FeCl2固体后,电流计读数为零 |
17.用NA表示阿伏伽德罗常数的值,则下列叙述正确的是( )
| A. | 40gSiC晶体中含有2NA个Si-C共价键 | |
| B. | 标准状况下,22.4LCl2作为反应物参加反应时,转移的电子数一定为2NA | |
| C. | 1mol的CH≡CH中,所含σ键的总数为3NA | |
| D. | 常温常压下,100mL0.5mol/L的醋酸溶液中,醋酸根离子的数目为0.05NA |
4.X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种物质中的一种.下表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH.
(1)X、Z的化学式分别为NaOH、NaNO2.
(2)W的电离方程式是NH4NO3═NH4++NO3-.
(3)常温下,W的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将浓度均为1mol/L的X、Z两种溶液各取20mL配成混合溶液,该混合溶液中各离子的浓度由大到小的顺序是c(Na+)>c(OH-)>c(NO2-)>c(H+).
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)W的电离方程式是NH4NO3═NH4++NO3-.
(3)常温下,W的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将浓度均为1mol/L的X、Z两种溶液各取20mL配成混合溶液,该混合溶液中各离子的浓度由大到小的顺序是c(Na+)>c(OH-)>c(NO2-)>c(H+).
14.根据下列各反应现象所归纳的元素性质不正确的是( )
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出.不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝.说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出.说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol.说明这三种金属的活泼性为:Al>Mg>Na |
1.下列说法正确的是( )
| A. | 乙烯、苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| C. | 油脂水解的产物是氨基酸和甘油 | |
| D. | 淀粉和聚乙烯都是天然髙分子化合物 |
20.一种荧光氨基酸的结构简式如图所示,有关该化合物的说法正确的是( )
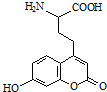

| A. | 分子中含有2个手性碳原子 | |
| B. | 能与强酸反应 | |
| C. | 1mol该有机物最多可与1molBr2发生反应 | |
| D. | 1mol该有机物最多可与含4molNaOH的溶液反应 |