题目内容
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:________。
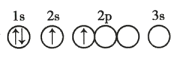
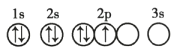
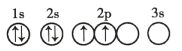
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、
H、![]() C、
C、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
①以上8种微粒共有________种核素,共________种元素。
②互为同位素的是________。
③质量数相等的是________和________,中子数相等的是________和________。
(3)相同物质的量的![]() 与
与![]() 的质量之比为________;中子数之比为________;电子数之比为________。
的质量之比为________;中子数之比为________;电子数之比为________。
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是______________。(铷的相对原子质量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标准状况下的体积之比为________。
【答案】![]()
![]() 5
5 ![]() H、
H、![]() H、
H、![]() 14C
14C ![]()
![]() C
C ![]()
![]() :34 2:3 11:16
:34 2:3 11:16 ![]() 或Na
或Na ![]() :9
:9
【解析】
(1)质子数为8的原子,则为O,质量数=质子数+中子数=8+18=18,化学符号为![]() ;
;
(2)①具有一定数目质子和一定数目中子的一种原子称为核素,则共有6种核素;5种元素;
②同位素为质子数相等,而中子数不等的原子,则![]() H、
H、![]() H、
H、![]() 互为同位素;
互为同位素;
③质量数相等的是![]() C和
C和![]() ,中子数相等的是
,中子数相等的是![]() C和
C和![]() 。
。
(3)相同物质的量的![]() 与
与![]() 的质量,m(
的质量,m(![]() ):m(
):m(![]() )=n×46:n×68=23:34;中子数之比=n×24:n×36=2:3;电子数之比=n×22:n×32=11:16;
)=n×46:n×68=23:34;中子数之比=n×24:n×36=2:3;电子数之比=n×22:n×32=11:16;
(4)M=![]() =
=![]() =39g/mol,铷摩尔质量为85.5g/mol,则另一碱金属的摩尔质量小于平均值,则只能是Na或Li;
=39g/mol,铷摩尔质量为85.5g/mol,则另一碱金属的摩尔质量小于平均值,则只能是Na或Li;
(5)质量相同的H2O和D2O,物质的量分别为![]() mol、
mol、![]() mol,与足量钠反应生成氢气的量与水的物质的量有关,则氢气的物质的量的比为
mol,与足量钠反应生成氢气的量与水的物质的量有关,则氢气的物质的量的比为![]() :
:![]() =20:18=10:9,相同条件下,物质的量之比等于体积之比,则体积比为10:9。
=20:18=10:9,相同条件下,物质的量之比等于体积之比,则体积比为10:9。

 口算题天天练系列答案
口算题天天练系列答案【题目】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
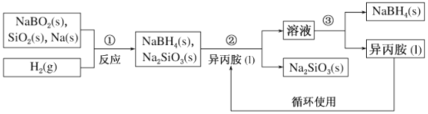
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
pH | 8 | 10 | 12 | 1 4 |
温度/℃ | 25 | 25 | 25 | 25 |
时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
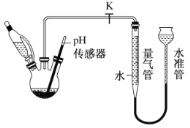
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。