题目内容
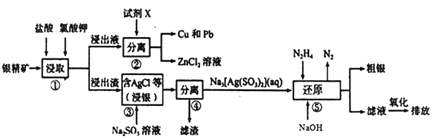
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
【答案】溶解过滤CaCl2+Na2CO3===CaCO3↓+2NaCl BaCl2+Na2CO3===BaCO3↓+2NaCl操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度取少量第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量。
【解析】
(1)粗盐提纯须先加水溶解,再加入试剂BaCl2、NaOH、Na2CO3除去可溶性的![]() 、Mg2+、Ca2+,过滤后,加入盐酸除去过量的NaOH、Na2CO3,最后蒸发、结晶得到精盐,操作A为溶解,操作B为过滤;(2)Na2CO3的作用是除去溶质中Ca2+以及过量的Ba2+,因此反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;(3)若先用盐酸调pH再过滤,将使产生的Mg(OH)2、CaCO3、BaCO3沉淀溶解而无法过滤除去,影响精盐的纯度;(4)BaCl2过量时,不存在
、Mg2+、Ca2+,过滤后,加入盐酸除去过量的NaOH、Na2CO3,最后蒸发、结晶得到精盐,操作A为溶解,操作B为过滤;(2)Na2CO3的作用是除去溶质中Ca2+以及过量的Ba2+,因此反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;(3)若先用盐酸调pH再过滤,将使产生的Mg(OH)2、CaCO3、BaCO3沉淀溶解而无法过滤除去,影响精盐的纯度;(4)BaCl2过量时,不存在![]() ,故再滴入几滴BaCl2溶液,看是否有白色沉淀生成,即可判断BaCl2是否过量。
,故再滴入几滴BaCl2溶液,看是否有白色沉淀生成,即可判断BaCl2是否过量。