题目内容
【题目】一定温度下,在密闭容器中充入4moIX,当反应4X(g)3Y(g)+Z(g)达到平衡状态时,有30%的X发生分解,则达到平衡状态时混合气体的总物质的量是( )
A.4mol
B.3.4mol
C.2.8mol
D.1.2mol
【答案】A
【解析】解:反应方程式4X(g)3Y(g)+Z(g)中气体的体积不变,则反应过程中混合气体的总物质的量始终不变,仍然为4mol,
故选A.

【题目】某学生欲用0.100 0 mol·L-1的盐酸来滴定未知浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用0.100 0 mol·L-1的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由红色变为无色,且____________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____________mL,终点读数为____________mL。

(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 氢氧化钠溶液/mL | 0.100 0 mol·L-1 盐酸的体积(mL) | ||
滴定前 | 滴定后 | 消耗 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______________。
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备NaN3
水合肼(N2H4·H2O) 与亚硝酸甲酯(CH3ONO)在氢氧化钠存在下制备NaN3,其反应装置如图所示:
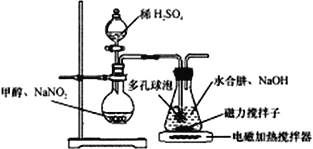
已知:2CH3OH+2NaNO2+H2SO4→2CH3ONO+ Na2SO4+2H2O; NaN3无色无味,微溶于醇、溶于水
(1)N2H4的电子式为_______________;NaN3晶体中阴离子与阳离子个数比为______________。
(2)装置中多孔球泡的作用是___________________。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,写出该反应的化学方程式_______________________________。
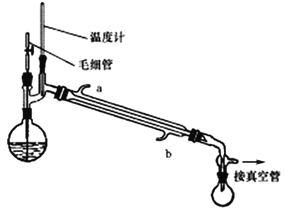
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照下图所示装置进行减压蒸馏。
已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
NaN3在40℃时分解
(4)实验时冷凝管中冷却水要“b进a出”原因是______________________。
(5)甲醇回收时需用减压蒸馏的原因是________________________。
(6)下列有关毛细管的作用说法正确的是_______________。
A.平衡圆底烧瓶内外压 B.作为气化中心,使蒸馏平稳
C.避免液体过热而暴沸 D.冷凝回流作用
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得NaN3湿品;再用去离子水重结晶得NaN3产品并用碘量法测定产品纯度。取产品6.50g加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入20.00mL 1.00mol·L-lKMnO4溶液,溶液呈紫红色;再加入足量KI溶液消耗过量的KMnO4溶液;其后用0.100mol·L-lNa2S2O3标准溶液滴定所产生的I2,消耗Na2S2O3溶液30.00mL。
(7)实验所得产品的纯度为______________________。
已知:①产品中杂质不参与反应;
②测定过程中发生的反应:
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。