��Ŀ����
����Ŀ��һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25���� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
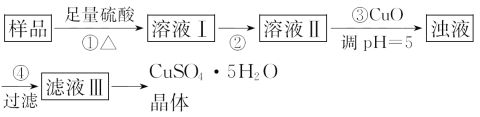
B. ����Һ�м���˫��ˮ������CuO��ĩ��pH�����˺�ɻ�ϴ�����CuSO4��Һ
C. ����Һ��һ����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D. ������FeCl3��ĩ���뺬Cu��OH��2������Һ�У�����c��Cu2+������
���𰸡�C
��������A��Fe2(SO4)3���ֳ���ʱ��Ҫ��OH����Ũ��:c(OH��)= ![]() =
= ![]() ��
��
2��10��13mol��L��1��FeSO4��Һ�����ֳ���c(OH��)= ![]() =
= ![]() =4��10��8��CuSO4��Һ�����ֳ���c(OH��)=
=4��10��8��CuSO4��Һ�����ֳ���c(OH��)= ![]() =
= ![]() =
=![]()
![]() ��10��10�����Եó�������������Ϊ����������������˵����ȷ��B������˫��ˮ��Ŀ���ǰ�Fe2��������Fe3����Ȼ�����CuO��Ca(OH)2������pH��ʹFe3����Fe(OH)3�������Ӷ��õ�������CuSO4��Һ����˵����ȷ��C�����趼Ϊ1mol��n(SO42��)=5mol��n(Fe2��)��n(Fe3��)��n(Cu2��)=4mol���������߽��������ӷ���ˮ�⣬�����ʵ���֮��С��4mol�����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]>5��4����˵��������D�����뵽������ͭ����Һ�У�����Fe(OH)3��������Һ��Cu2��Ũ������˵����ȷ��
��10��10�����Եó�������������Ϊ����������������˵����ȷ��B������˫��ˮ��Ŀ���ǰ�Fe2��������Fe3����Ȼ�����CuO��Ca(OH)2������pH��ʹFe3����Fe(OH)3�������Ӷ��õ�������CuSO4��Һ����˵����ȷ��C�����趼Ϊ1mol��n(SO42��)=5mol��n(Fe2��)��n(Fe3��)��n(Cu2��)=4mol���������߽��������ӷ���ˮ�⣬�����ʵ���֮��С��4mol�����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]>5��4����˵��������D�����뵽������ͭ����Һ�У�����Fe(OH)3��������Һ��Cu2��Ũ������˵����ȷ��

 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�