��Ŀ����
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ������
��1����CO2�뽹̿��������CO��CO��������������
��֪��
Fe2O3��s��+3CO��s��ʯī���T2Fe��s��+3CO2��g����H1=+489.0kJmol��1
C��s��ʯī��+CO2��g���T2CO��g����H2=+172.5kJmol��1
��CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪ_____��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H
CH3OH��g��+H2O��g����H
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ��Ӧ�����в�ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�ġ�H____0�����������������=������ͬ����
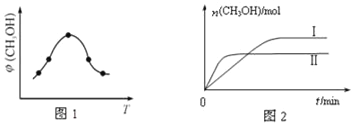
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ������I������Ӧ��ƽ�ⳣ����ϵΪK��_____K����
��3����CO2Ϊԭ�ϻ����Ժϳɶ���������
�ٹ�ҵ������[CO��NH2��2]��CO2��NH3��һ�������ºϳɣ���ʼ��̼��![]() =3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ_____��
=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ_____��
�ڽ�����CO2ͨ�뱥�Ͱ�ˮ�пɵõ���NH4HCO3����֪������һˮ�ϰ�Kb=1.8��10��5��̼��һ�����볣��Ka=4.3��10��7����NH4HCO3��Һ��_____������ԡ��������ԡ����ԡ�����
���𰸡� Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��28.5 kJmol��1 �� �� 40% ����
����������1�����⿼���Ȼ�ѧ��Ӧ����ʽ���㣬��Fe2O3(s)+3C(s��ʯī)��2Fe(s)+3CO(g)����C(s��ʯī)+CO2(g)��2CO(g)���٣�3���ڵó���Fe2O3(s)+3CO(s��ʯī)��2Fe(s)+3CO2(g) ��H=(489��3��172.5)kJ��mol��1=��28.5kJ��mol��1����2�����⿼����������ԭ������ѧƽ�ⳣ���ļ����֪ʶ���ٿ���Ӱ�컯ѧƽ������أ�Ӧ�Ƚ���һ����ѧƽ�⣬Ȼ��ı�ijһ���أ�ƽ�ⷢ���ƶ�����ߵ㽨����ѧƽ�⣬��ߵ��Ժ������¶����ߣ��״�������������ͣ�˵��ƽ�����淴Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ����H<0�����¶ȸߣ���ѧ��Ӧ���ʿ죬�ȴﵽƽ�⣬����ͼ��2��II���¶ȸ���I����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�˷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����KI>KII����3���ٷ�Ӧ����ʽΪCO2��2NH3=CO(NH2)2��H2O����n(NH3)=3mol����n(CO2)=1mol��CO2��ת����Ϊ60%������CO2�����ʵ���Ϊ1��60%mol=0.6mol������NH3�����ʵ���Ϊ2��0.6mol=1.2mol����NH3��ת����Ϊ1.2/3��100%=40%����HCO3��ˮ�⣺HCO3����H2O ![]() H2CO3��OH����Kh=c(OH��)��c(H2CO3)/c(HCO3��)=c(OH��)��c(H2CO3)/[c(HCO3��)��c(H��)]=Kw/Ka1=10��14/4.3��10��7=2��10��8��ͬ��NH4����ˮ��ƽ�ⳣ��=10��14/1.8��10��5=6��10��10��ˮ��ƽ�ⳣ��Խ��˵��ˮ��̶�Խ�����̼����淋�ˮ��Һ�Լ��ԡ�
H2CO3��OH����Kh=c(OH��)��c(H2CO3)/c(HCO3��)=c(OH��)��c(H2CO3)/[c(HCO3��)��c(H��)]=Kw/Ka1=10��14/4.3��10��7=2��10��8��ͬ��NH4����ˮ��ƽ�ⳣ��=10��14/1.8��10��5=6��10��10��ˮ��ƽ�ⳣ��Խ��˵��ˮ��̶�Խ�����̼����淋�ˮ��Һ�Լ��ԡ�

����Ŀ��һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25���� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
B. ����Һ�м���˫��ˮ������CuO��ĩ��pH�����˺�ɻ�ϴ�����CuSO4��Һ
C. ����Һ��һ����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D. ������FeCl3��ĩ���뺬Cu��OH��2������Һ�У�����c��Cu2+������