��Ŀ����
����Ŀ��ʵ�����ú�������(FeO��Fe2O3)�ķ�CuO�Ʊ��������徭�����й���(��֪��Fe3+��pH=5ʱ����ȫ����)��
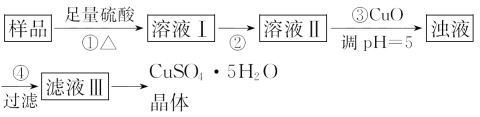
���з�����ȷ����( )
A.��98%��Ũ���������ܽ����õ�4.5 mol��L-1��ϡ���ᣬ��4�ֲ�������
B.�����Ŀ���ǽ���Һ���е�Fe2+���ת����Fe3+��ʵ�����������Һ����ͨ������������
C.����Cu(OH)2���CuOҲ�ɵ�����ҺpH����Ӱ��ʵ����
D.�����֮���ʵ������������ܼ��ᾧ�������������������������ƾ��ơ������ǡ����ż�
���𰸡�C
��������ѡC����Ũ��������һ�����ʵ���Ũ�ȵ�ϡ������Һ����ʹ����Ͳ��ȡŨ�����������ܽ������Ҫ�ձ��Ͳ���������Ҫ�õ�����ƿ�ͽ�ͷ�ιܣ�A�������������Fe2+��ѡ��Cl2�����������Եõ������ĵ������壬���������ѡ��H2O2��B�������֮��Ҫ�õ��������壬Ӧͨ����������Ũ������ȴ�ᾧ�ķ�����������������Ҫ�����ǣ����ż�Ҳ�ɸ�Ϊ����̨����Ȧ��D����

����Ŀ��һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25���� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
B. ����Һ�м���˫��ˮ������CuO��ĩ��pH�����˺�ɻ�ϴ�����CuSO4��Һ
C. ����Һ��һ����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D. ������FeCl3��ĩ���뺬Cu��OH��2������Һ�У�����c��Cu2+������
