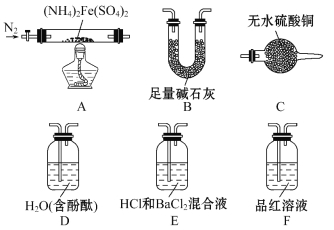
��Ŀ����
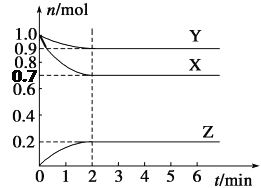
����Ŀ��ij�¶��£���2 L���ܱ������У�X��Y��Z����������ʱ��仯��������ͼ��ʾ��
��ش��������⣺
(1)��ͼ�����ݷ������÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
(2)��Ӧ��ʼ��2 min��Z��ƽ����Ӧ����Ϊ________��
(3)5 minʱZ������������6 minʱZ������������Ƚϣ�ǰ��________����(����ڡ�����С�ڡ����ڡ�)��
(4)������Ӧ�����У���������¶ȣ����䷴Ӧ����________(���������С������)��
���ʹ�ú��ʵĴ��������䷴Ӧ����________ (���������С������)��
(5)���и�����������˵��������Ӧ�ﵽƽ�����________(����ĸ)��
a�����������ܶȲ���
b����������ѹǿ����
c��ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ����
d��X��Ũ�ȱ��ֲ���
e������1 mol Z��ͬʱ����1.5 mol X
f��X��Y��Z�ķ�Ӧ����֮��Ϊ3��1��2
(6)�����ֲ�ͬ�������²ⶨ�õ����·�Ӧ���ʣ����б�ʾ�ķ�Ӧ����������______��
��v(X)=0.6 mol��L-1��min-1 ��v(Y)=0.2 mol��L-1��min-1
��v(Z)=0.1 mol��L-1��s-1 ��v(Z)=0.1 mol��L-1��min-1
���𰸡� 3X+Y ![]() 2Z 0.05 mol.L-1.min-1 ���� ��С ���� a��f ��
2Z 0.05 mol.L-1.min-1 ���� ��С ���� a��f ��
�����������������
(1)X��Y���ʵ���������X��Y�Ƿ�Ӧ�Z�����ʵ�������Z�������2min�����ʵ������ٸı�����ӦΪ���淴Ӧ���ɸ�����ת��������֪��ѧ����ʽ�и����ʵļ�����֮����
(2)����![]() ���㷴Ӧ������
���㷴Ӧ������
(3)��Ӧ�ﵽƽ���Ӧ���ʲ��ٸı���
(4)�����¶ȷ�Ӧ���ʼ�С��
�����ܼӿ췴Ӧ���ʡ�
(5)����ƽ�ⶨ�����ƽ���־��
��6���ȽϷ�Ӧ������Ҫͳһ���ʵ�λ��ͳһ������
������(1)X��Y���ʵ���������X��Y�Ƿ�Ӧ�Z�����ʵ�������Z�������2min�����ʵ������ٸı�����ӦΪ���淴Ӧ��XΪ0.3 mol��YΪ0.1 mol��ZΪ0.2 mol����֪��ѧ����ʽ�и����ʵĻ�ѧ������֮��Ϊ,3��1��2������ʽΪ3X+Y ![]() 2Z
2Z
(2)����![]() ��
�� ![]() 0.05 mol.L-1.min-1��
0.05 mol.L-1.min-1��
(3)��Ӧ�ﵽƽ���Ӧ���ʲ��ٸı䣬����5 minʱZ���������ʵ���6 minʱZ�����������ࡣ
(4)�����¶ȷ�Ӧ���ʼ�С�������ܼӿ췴Ӧ���ʡ�
(5) a������![]() ,�ܶ��Ǻ���,���������ܶȲ���,��һ��ƽ�⣻
,�ܶ��Ǻ���,���������ܶȲ���,��һ��ƽ�⣻
b����Ӧǰ����������ʵ����ı䣬����ѹǿ�DZ�������������ѹǿ������һ���ﵽƽ��״̬��
c������ƽ�ⶨ�壬ͬһ���ʵ�����Ӧ���ʵ����淴Ӧ������һ���ﵽƽ��״̬��
d������ƽ�ⶨ����X��Ũ�ȱ��ֲ�����һ���ﵽƽ��״̬��
e������1 mol Z��ͬʱ����1.5 mol X�����淴Ӧ������ȣ�һ���ﵽƽ��״̬��
f������ʱ��X��Y��Z�ķ�Ӧ����֮�ȶ���3��1��2����һ��ƽ�⣻��ѡa��f��
��6������![]() ����v(X)��3=0.2 mol��L-1��min-1 �� v(Y) ��1=0.2 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��s-1 =3 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��min-1 ����Ӧ��������������
����v(X)��3=0.2 mol��L-1��min-1 �� v(Y) ��1=0.2 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��s-1 =3 mol��L-1��min-1 �� v(Z) ��2=0.05 mol��L-1��min-1 ����Ӧ��������������

����Ŀ��һ���¶��£�����ǿ����ʵı�����Һ�д����ų����ܽ�ƽ�⣬��ƽ�ⳣ��Ϊ
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp��25���� | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
���ں�Fe2(SO4)3��FeSO4��CuSO4��0.5mol�Ļ����Һ1L�������ϱ������жϣ�˵���������
A. ������Һ����μ���NaOH��Һ�����ȿ������ɫ����
B. ����Һ�м���˫��ˮ������CuO��ĩ��pH�����˺�ɻ�ϴ�����CuSO4��Һ
C. ����Һ��һ����c��SO42������[c��Fe3+��+c��Fe2+��+c��Cu2+��]=5��4
D. ������FeCl3��ĩ���뺬Cu��OH��2������Һ�У�����c��Cu2+������