题目内容
8.某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为C7H8O.若1mol X与浓溴水反应时消耗了3mol Br2,则X的结构简式为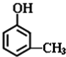 .
.
分析 有机物X分子中只含C、H、O三种元素,B的相对分子质量小于110,其中含氧的质量分数为14.8%,分子中氧原子最大数目小于$\frac{110×14.8%}{16}$=1.02,故X中氧原子数目为1,Mr(X)=$\frac{16}{14.8%}$=108,该物质可与FeCl3溶液发生显色反应,说明含有酚羟基,假设为二元取代,减去1个-C6H4-、1-OH后剩余基团的式量=108-76-17=15,则剩余基团为-CH3,故X的分子式为C7H8O,则X为甲基苯酚;
若1molX与浓溴水反应时消耗了3molBr2,溴发生酚羟基的邻、对位取代,故X中甲基与酚羟基处于间位位置,据此写出X的结构简式.
解答 解:有机物X分子中只含C、H、O三种元素,B的相对分子质量小于110,其中含氧的质量分数为14.8%,分子中氧原子最大数目小于$\frac{110×14.8%}{16}$=1.02,故X中氧原子数目为1,Mr(X)=$\frac{16}{14.8%}$=108,
该物质可与FeCl3溶液发生显色反应,说明含有酚羟基,假设为二元取代,减去1个-C6H4-、1-OH后剩余基团的式量=108-76-17=15,则剩余基团为-CH3,
故X的分子式为C7H8O,
由上述分析可知,X为甲基苯酚,若1molX与浓溴水反应时消耗了3molBr2,溴发生酚羟基的邻、对位取代,故X中甲基与酚羟基处于间位位置,
所以X的结构简式为 ,
,
故答案为:C7H8O; .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,(2)为易错点,需要根据X的性质确定甲基的位置,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的干燥剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,二者可快速反应产生二氧化碳气体 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
19.下列说法中错误的是( )
| A. | 1mol氢气所占体积约为22.4L | |
| B. | 气态物质所占的体积主要由分子数目和分子间距离决定的 | |
| C. | 1molO2与1molO3所含的分子数目相等 | |
| D. | 物质的聚集状态不同主要是构成物质的基本粒子间的距离不同 |
20.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增加
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
①生成物的百分含量一定增加
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥使用了合适的催化剂.
| A. | ①② | B. | ②⑤ | C. | ③⑤ | D. | ④⑥ |
17.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].常温下,在AG=10的溶液中能大量共存的离子是( )
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |