题目内容
【题目】海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源。将海水淡化与浓缩海水结合是综合利用海水资源的途径之一。以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品。
(1)如图是采用膜分离技术的海水淡化示意图。

淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过。加压后,左侧淡水中增加的是__________(填字母)。
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)从海水中提取镁的主要步骤如下:

①操作a的名称是_______________。
②写出B冶炼金属镁的化学方程式_______________________________。
(3)空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴:
步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴。
①步骤一和步骤二的目的是___________________________________。
②步骤二中发生反应的化学方程式为___________________________。
【答案】 b 过滤 MgCl2(熔融) ![]() Mg + Cl2↑ 富集溴(其他合理答案均可得分) Br2 + SO2 + 2H2O = 2HBr + H2SO4
Mg + Cl2↑ 富集溴(其他合理答案均可得分) Br2 + SO2 + 2H2O = 2HBr + H2SO4
【解析】(1)由图示知,水分子可以透过淡化膜到左侧淡水池,而海水中的各种离子不能通过淡化膜。故尽管左侧海水中的离子个数不变,溶质的质量不变,但水分子却在增大,溶剂质量增大,溶液质量增大,因此浓度会越来越小,即溶质的质量分数减小,故选b;
(2)①在海水中加入石灰水,得到氢氧化镁沉淀,因此操作a为过滤,故答案为:过滤;
②电解熔融的氯化镁冶炼金属镁的化学方程式为MgCl2(熔融) ![]() Mg + Cl2↑,故答案为:MgCl2(熔融)
Mg + Cl2↑,故答案为:MgCl2(熔融) ![]() Mg + Cl2↑;
Mg + Cl2↑;
(3)①步骤一用氯气置换溴离子使之成为单质溴、步骤二通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸,目的是富集溴,故答案为:富集溴;
②步骤二中发生反应的化学方程式为Br2 + SO2 + 2H2O = 2HBr + H2SO4,故答案为:Br2 + SO2 + 2H2O = 2HBr + H2SO4。

【题目】钨主要用于制造硬质或耐高温的合金。自然界中黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。黑钨矿冶炼钨的工艺流程如下:
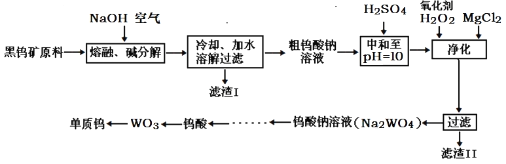
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为__________,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是__________,滤渣Ⅱ的主要成分是__________。
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表。
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成分 | WO3 W2O5 WO2 W |
已知:温度过高时,WO2(s)可转变为WO2(g)。
WO2(s)+2H2(g) ![]() W(s)+2H2O(g) △H =+66.0 kJ·mol-1
W(s)+2H2O(g) △H =+66.0 kJ·mol-1
WO2(s) ![]() WO2(g) △H =+203.9 kJ·mol-1
WO2(g) △H =+203.9 kJ·mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为_____________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小。不同温度下两种物质的沉淀溶解平衡曲线如右图,则T1时Ksp(CaWO4) =________。
在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为________。
(5)利用电解法可以从碳化钨(WC)废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为____________。

