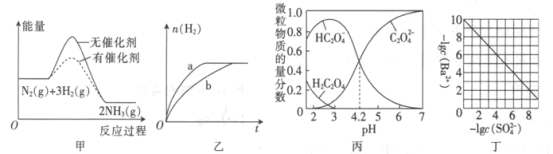
题目内容
【题目】某实验小组在T1温度下,容积为1 L的恒容密闭容器中,同时通入0.1 mol CO(g)和0.1 mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
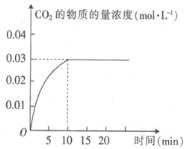
(1)0~10min内,CO的平均反应速率为_______________。
(2)T1温度下,该反应的平衡常数K为________(用分数表示)。
(3)①已知:
I.H2的燃烧热△H=-285.8 kJ· mol-1;
II.CO的燃烧热△H=-283 kJ· mol-1;
III.H2O(g)=H2O(l) △H=-44 kJ· mol-1。
则a=_______。
②反应达到平衡后,下列措施能使平衡向正反应方向移动的是__________(填字母)。
A 升高温度 B 增大压强 C 通入H2O(g) D 移走CO2(g)
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1,c(H2)=0.4 mol·L-1,c(CO2)=0.4 mol·L-1,则该反应在下-时刻将____(填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_______。
【答案】0.003mol·L-1·min-1 ![]() -41.2 CD 向正反应方向进行
-41.2 CD 向正反应方向进行 ![]() <K,所以反应向正反应方向进行
<K,所以反应向正反应方向进行
【解析】
(1)利用![]() ,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比;
,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比;
(2)利用三等式,求解平衡常数;
(3)①利用盖斯定律,求解反应热;
②根据勒夏特列原理判断平衡移动;
(4)利用浓度商Qc和K的关系,判断平衡移动方向。
(1)根据图示,0~10min内,CO2的浓度增加了0.03mol·L-1,则![]() ,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比,即
,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比,即![]() ,则
,则![]() ;
;
(2) 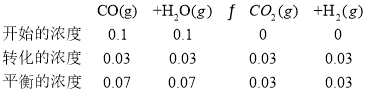
则![]() ;
;
(3)①H2的燃烧热的热化学方程式H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1 ①;
CO的燃烧热的热化学方程式CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1 ②;
H2O(g)=H2O(l) △H=-44 kJ· mol-1 ③,则②-①+③得到CO(g)+H2O(g)![]() CO2(g)+H2(g),△H=-283-(-285.8)+(-44)kJ·mol-1=-41.2 kJ·mol-1,则a=-41.2;
CO2(g)+H2(g),△H=-283-(-285.8)+(-44)kJ·mol-1=-41.2 kJ·mol-1,则a=-41.2;
②A、升高温度,向吸热反应方向移动,即逆向移动,A不符合题意;
B、由于反应前后气体体积不变,增大压强,平衡不移动,B不符合题意;
C、通入H2O,增大反应物浓度,正向移动,C符合题意;
D、移走CO2,减小生成物浓度,正向移动,D符合题意;
答案为CD;
(4)利用浓度商Q与K的关系判断平衡移动方向,![]() <K,则平衡正向移动,答案为向正反应方向进行,
<K,则平衡正向移动,答案为向正反应方向进行,![]() <K,所以反应向正反应方向进行。
<K,所以反应向正反应方向进行。

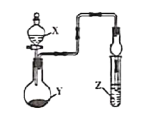
【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,下列关于试管中的现象描述错误的是
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 稀硫酸 | Na2O2 | 氢硫酸 | 产生淡黄色沉淀 | |
B | 浓氨水 | 碱石灰 | 氯化铝溶液 | 产生白色沉淀 | |
C | 浓硝酸 | Cu | 硅酸钠溶液 | 产生白色沉淀 | |
D | 稀盐酸 | CaCO3 | 氯化钡溶液 | 产生白色沉淀 |
A.AB.BC.CD.D