题目内容
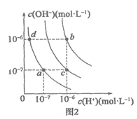
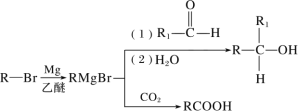
【题目】有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图__________;C2粒子的符号:__________;
(2)B、E两种元素形成化合物的电子式:___________;
(3)A、E两种元素形成的氢化物沸点较高的是:____________(用化学式表示),其原因是__________________________;
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式________;
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式_________________________________。
【答案】![]() D或2H
D或2H ![]() HF HF分子之间存在氢键 NH3+H+=NH4+ 8NH3+Cl2=2NH4Cl+3N2
HF HF分子之间存在氢键 NH3+H+=NH4+ 8NH3+Cl2=2NH4Cl+3N2
【解析】
A是非金属性最强的元素,则A是F元素,E与A同主族,则E是Cl元素;D的气态氢化物溶于水后显碱性,则D是N元素;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3,则C是H元素;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu,则B是Na元素。据此解答。
(1)Na元素的离子核外有10个电子,结构示意图为![]() ;C2粒子的质量数是2,所以C2粒子是D或2H;
;C2粒子的质量数是2,所以C2粒子是D或2H;
(2)B、E形成的化合物是氯化钠,属于离子化合物,电子式为![]() ;
;
(3)F、Cl形成的氢化物中沸点较高的是HF,因为HF分子间存在氢键,使分子间作用力增大,沸点升高;
(4)D的气态氢化物是氨气,其最高价氧化物的水化物是硝酸,二者反应的离子方程式为NH3+H+=NH4+
(5)过量氨气与氯气发生氧化还原反应生成氮气和氯化铵,化学方程式为8NH3+Cl2=2NH4Cl+3N2。

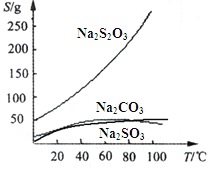
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S = Na2S2O3 。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。
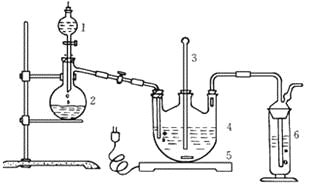
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为______________,装置6中可放入___________。
A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
![]()
(3)为减少产品的损失,操作①为__________,操作②是过滤洗涤干燥,其中洗涤操作是用________(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于__________(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:_____________________。
③产品中Na2S2O3·5H2O的质量分数为______________。