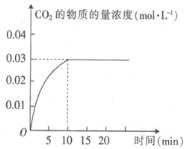
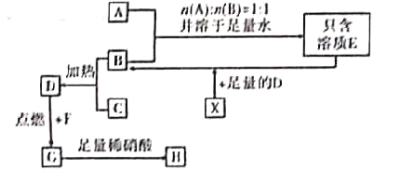
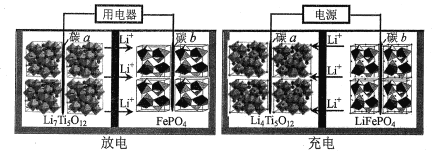
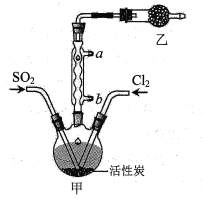
题目内容
【题目】高铁酸钾是常见的水处理剂,工业上制备高铁酸钾有多种方法。某兴趣小组以铁屑为原料模拟制备高铁酸钾的流程如下:
(查阅资料)高铁酸钾呈紫红色,在酸性或中性溶液中快速产生O2。
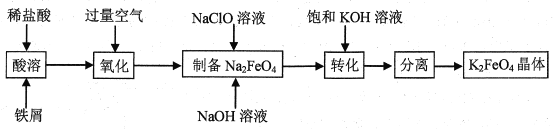
回答下列问题:
(1)“氧化”阶段通入空气作氧化剂,它比用氯气具有的优点是___。
(2)为了检验“氧化”过程中所得FeCl3溶液中是否还含有Fe2+,最佳的检验试剂是___(填标号)。
a.K3[Fe(CN)6]溶液 b.NaOH溶液 c.淀粉KI试纸
(3)请写出“制备”反应的离子方程式___。
(4)“转化”过程使用过量饱和KOH溶液的原因是___。
(5)“分离”过程获得K2FeO4晶体的系列操作是蒸发,结晶、过滤、洗涤、干燥,其中洗涤使用的最佳洗涤剂是___(填标号)。
a.冷水 b.冷的稀NaOH溶液 c.冷的浓KOH溶液
(6)电解法制备K2FeO4,操作简单,易于实验室制备原理如图所示,其中阳极的电极反应式是___。

(7)探究K2FeO4的性质。取电解后的紫红色溶液,加入稀盐酸,观察到溶液由紫红色逐渐变为黄色,并收集到黄绿色气体。甲同学认为:气体中一定含有Cl2;乙同学认为:气体中还可能含有___。请设计实验证明乙同学的猜测___。
【答案】选用通入空气经济、而且氯气有毒,污染环境 a 2Fe2++3ClO- +10OH- =2 FeO42++3Cl-+5 H2O 防止K2FeO4在溶液中会水解成H2FeO4 c Fe-6e-+8OH- ═ FeO42-+4H2O和4OH--4e-═2H2O+O2↑ 氧气 将气体中通入过量NaOH溶液的洗气瓶,收集气体用带火星的木条检验,若木条复燃,则乙猜测正确
【解析】
(1)选用通入空气经济、而且氯气有毒,污染环境,故“氧化”阶段通入空气作氧化剂比用氯气更好;故答案为:选用通入空气经济、而且氯气有毒,污染环境;
(2)Fe2+和K3[Fe(CN)6]溶液反应生成蓝色沉淀,可用来检验亚铁离子;故选a;
(3)Fe2+和NaClO、NaOH溶液混合得到Na2FeO4,铁元素化合价升高,则氯元素化合价降低,生成氯化钠,故反应为:2Fe2++3ClO- +10OH- =2 FeO42++3Cl-+5 H2O;
(4)饱和KOH溶液可以让Na2FeO4转化为K2FeO4,K2FeO4在水溶液中会水解成H2FeO4和氢氧根,这个反应是可逆反应,过量KOH溶液可以使反应左移,防止K2FeO4在溶液中会水解成H2FeO4;故答案为:防止K2FeO4在溶液中会水解成H2FeO4;
(5)洗涤剂要求不能加入新的杂质,还要防止K2FeO4在溶液中水解,最好用冷的浓KOH溶液,故选c;
(6)根据电源的正负极判断电极名称,该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,电极反应式为:Fe-6e-+8OH- ═ FeO42-+4H2O和4OH--4e-═2H2O+O2↑;
(7)气体中还可能含有氧气,鉴定氧气可以先将气体中通入过量NaOH溶液的洗气瓶,收集气体用带火星的木条检验,若木条复燃,则乙猜测正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案