题目内容
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,R为过渡元素。Y的最高价氧化物的水化物是强酸,Z元素的基态原子中有2个未成对电子,基态W原子的价电子排布式为nsn-1npn-1,X与W为同主族元素。基态R原子的M能层全充满,核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子核外价电子排布式为___。
(2)X、Y、Z三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(3)元素Y的简单气态氢化物的沸点___(填“高于”或“低于”)元素X的简单气态氢化物的沸点,其主要原因是___;元素Y的简单气态氢化物中Y原子的杂化类型为___,元素X的简单气态氢化物分子的空间构型为___。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___(填序号)。
A.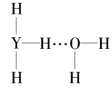 B.
B. 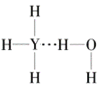 C.
C.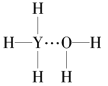 D.
D.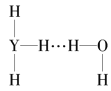
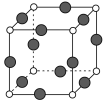
(5)R元素与Y元素形成的某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶胞的边长是acm,则该晶体的密度为___g·cm-3(用NA表示阿伏加德罗常数的值)。
【答案】3d104s1 N>O>C 高于 NH3分子间形成氢键 sp3 正四面体 B ![]()
【解析】
X、Y、Z、W为原子序数递增的短周期主族元素,基态W原子价层电子排布式为nsn-1npn-1,则n=3,W为Si元素,X与W为同主族元素,则X为C元素;Y的最高价氧化物的水化物是强酸,且原子序数大于C小于Si,则Y为N元素;Z元素基态原子中有2个未成对电子,原子序数大于C小于Si,则其核外电子排布应为1s22s22p4,为O元素;基态R原子M能层全充满且核外有且仅有1个未成对电子,价层电子排布为3d104s1,R为Cu元素。
(1)根据分析可知R为Cu元素,基态Cu原子的核外电子排布式为ls22s22p63s23p63d104sl,其核外价层电子排布式为3d104s1;
(2)同一周期,从左到右,元素的第一电离能呈增大趋势,但N原子的2p为半充满,较稳定,第一电离能大于O,所以三种元素的第一电离能从大到小的顺序为N>O>C;
(3)NH3分子间形成氢键,导致氨气的沸点大于甲烷;NH3分子中N原子价层电子对数为![]() =4,采用sp3杂化;X为C元素,其简单氢化物为甲烷,甲烷为正四面体结构;
=4,采用sp3杂化;X为C元素,其简单氢化物为甲烷,甲烷为正四面体结构;
(4)氢键可以表示为X-H…Y,氨气溶于水生成NH3H2O,能够电离生成铵根离子和氢氧根离子,因此其氢键最可能的形式为是由氨气分子中N原子与水分子中的H原子之间形成,所以选C;
(5)R为Cu元素,晶胞中N原子的个数为![]() =1,Cu原子的个数为
=1,Cu原子的个数为![]() =3,所以晶胞的质量为
=3,所以晶胞的质量为![]() g,晶胞边长为acm,则晶胞的体积V=a3cm3,所以晶胞的密度为
g,晶胞边长为acm,则晶胞的体积V=a3cm3,所以晶胞的密度为![]() gcm-3。
gcm-3。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同;甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定;乙把一定体积的标准盐酸放入锥形瓶,把未知液NaOH溶液放入滴定管进行滴定。
(1)甲同学使用的是_______滴定管,乙同学使用的是________滴定管。
(2)甲同学的滴定管在用蒸馏水洗净后没有用标准盐酸润洗,乙同学的滴定管在用蒸馏水洗净后也没有用待测NaOH溶液润洗,其余操作均正确,这样甲同学测定结果________(偏大、偏小、无影响,下同),乙同学测定结果__________。
(3)乙同学选择酚酞作指示剂进行试验,如何来判断滴定终点:____________。
(4)甲同学根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据计算c(NaOH)=______________。