题目内容
9.某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平.B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味.它们之间的转化关系如图甲所示:
(1)A的结构式为
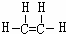 ,B中官能团的电子式为
,B中官能团的电子式为 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.(2)反应①的反应类型是加成反应,反应③的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图乙所示).重复操作2-3次,观察到的现象是铜丝由黑色变红色,产生刺激性气味.该反应的化学方程式为
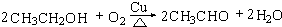 .
.(4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑.
(5)B、D在浓硫酸的作用下实现反应④,实验装置如图丙所示:试管1中装药品的顺序为先取B(填“B”、“D”、“浓硫酸”,下同),再加入浓硫酸,最后加入D.图中X的化学式为Na2CO3.浓硫酸的作用是催化剂、吸水剂.该反应的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结构D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯,则F为CH3COOCH2CH3).乙烯与溴发生加成反应生成1,2-二溴乙烷,用饱和的碳酸钠溶液吸收乙酸乙酯中的乙酸与乙醇,降低乙酸乙酯的溶解度,便于分层,据此答题.
解答 解:A是一种气态烃,在标准状况下的密度是1.25g/L,摩尔质量=1.25g/L×22.4L/mol=28g/mol,其产量是衡量一个国家石油化工发展水平,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结构D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成乙酸乙酯,则F为CH3COOCH2CH3).乙烯与溴发生加成反应生成1,2-二溴乙烷,用饱和的碳酸钠溶液吸收乙酸乙酯中的乙酸与乙醇,降低乙酸乙酯的溶解度,便于分层,
(1)由上述分析可知,A为乙烯,结构式为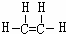 ;B为CH3CH2OH,含有官能团为羟基,羟基的电子式为
;B为CH3CH2OH,含有官能团为羟基,羟基的电子式为 ,D为CH3COOH,含有羧基,
,D为CH3COOH,含有羧基,
故答案为: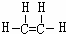 ;
; ;羧基;
;羧基;
(2)反应①是乙烯与水发生加成反应生成乙醇;反应③是乙烯与溴发生加成反应生成1,2-二溴乙烷,反应方程式为:CH2=CH2+Br2→CH2BrCH2Br,
故答案为:加成反应;CH2=CH2+Br2→CH2BrCH2Br;
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图2所示).重复操作2-3次,观察到的现象是:铜丝由黑色变红色,产生刺激性气味,该反应的化学方程式为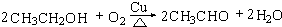 ,
,
故答案为:铜丝由黑色变红色,产生刺激性气味;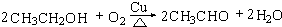 ;
;
(4)乙酸与碳酸氢钠溶液反应生成乙酸钠与二氧化碳与水,反应的离子方程式为:CH3COOH+HCO3-→CH3COO-+H2O+CO2↑,
故答案为:CH3COOH+HCO3-→CH3COO-+H2O+CO2↑;
(5)在乙酸乙酯的制备实验中,装药品的顺序为:先加入酒精,再加入浓硫酸,冷却后加入乙酸;
反应中浓硫酸其催化剂、吸水剂作用;
用饱和的碳酸钠溶液吸收乙酸乙酯中的乙酸与乙醇,降低乙酸乙酯的溶解度,便于分层;
该反应方程式为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:B;浓硫酸;D;Na2CO3;催化剂、吸水剂;CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查有机物推断、乙酸乙酯的实验室制备,掌握烯与醇、醛、羧酸之间的转化关系是关键,难度不大,注意基础知识的理解掌握.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | Cl2 | B. | CO2 | C. | NH3 | D. | SO2 |
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、SO42-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | K+、Mg2+、NO3-、Cl- |

 ;
;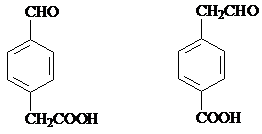 (只要求写出其中一种同分异构体)
(只要求写出其中一种同分异构体) 经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为
经过反应也可制得化合物IV,则R在NaOH醇溶液中反应的化学方程式为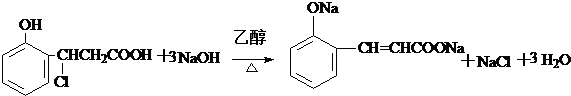 或
或 .
.