题目内容
【题目】某化学兴趣小组对电化学问题进行了实验探究。
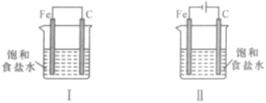
Ⅰ.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应式_______________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3:____________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol·L-1FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变血红;
据②、③、④现象得出的结论是______________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_________________。
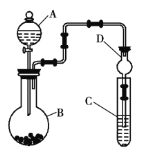
Ⅱ.利用如图装置作电解50 mL 0.5 mol·L-1的CuCl2溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①________________;②___________。
(2)分析实验记录B中浅蓝色固体可能是____(写化学式),试分析生成该物质的原因______。
【答案】Zn-2e-=Zn2+ 铁参与反应,被氧化生成Fe2+和Fe3+ 正极附近溶液不含Fe2+和Fe3+ 在钢铁表面刷一层油漆(其他合理答案均可) 2I-+Cl2=I2+2Cl- 5Cl2+I2+6H2O=10Cl-+2IO3—+12H+ Cu(OH)2 电解较长时间后,Cu2+浓度下降,H+开始放电,溶液pH增大,Cu2+转化为Cu(OH)2沉淀
【解析】
Ⅰ. 该装置能自发进行氧化还原反应而形成原电池,活泼金属锌做负极,失电子发生氧化反应生成锌离子,电极反应式为Zn-2e-=Zn2+,铁做正极,溶液中氢离子得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑;
Ⅱ.该装置为电解装置,电解时,氯离子在阳极失电子发生氧化反应生成氯气,电极反应式为2Cl——2e-=Cl2↑,铜离子在阴极上得电子发生还原反应生成铜,电极反应式为Cu2++2e-=Cu。
Ⅰ.(1)该装置能自发进行氧化还原反应而形成原电池,锌易失电子而作负极、铁作正极,负极上电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)由题给假设可知,假设三为:铁参与反应,铁被氧化生成Fe2+、Fe3+。故答案为:铁参与反应,被氧化生成Fe2+、Fe3+;
(3) 亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液,据②、③、④现象知,正极附近溶液不含Fe2+、Fe3+,即铁不参与反应,故答案为:正极附近溶液不含Fe2+、Fe3+;
(4) 可以采用物理或化学方法防止金属被腐蚀,如:在钢铁表面刷一层油漆、镀铜等,故答案为:在钢铁表面刷一层油漆、镀铜(其他合理答案均可);
Ⅱ. (1)由题意可知,氯气能氧化碘离子生成碘单质,碘能被氯气氧化生成碘酸,离子方程式分别为2I-+Cl2=I2+2Cl-、5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,故答案为:2I-+Cl2=I2+2Cl-、5Cl2+I2+6H2O=10Cl-+2IO3-+12H+;
(2)阴极上电极反应式为:Cu 2++2e-=Cu,当铜离子放电完毕后,氢离子放电,2H++2e-=H2↑,致使该电极附近呈碱性,Cu 2++2OH-=Cu(OH)2↓,故答案为:Cu(OH)2;电解较长时间后,Cu2+浓度下降,H+开始放电,溶液pH增大,Cu2+转化为Cu(OH)2。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】下面是元素周期表的一部分。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | A | |||||||
二 | D | J | L | |||||
三 | B | C | E | G |
根据以上元素在周期表中的位置,用元素符号或化学式填写空白。
(1)非金属性最强的元素是_____________;化学性质最不活泼的是__________;除L外,原子半价最大的是____________;A与D形成的10电子离子是_____________。/span>
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式排列:___________。
(3)B元素与氧形成的既含有离子键,又含共价键的化合物的电子式为____________。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________________。
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为___________(反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的aHCl—T曲线如图,则总反应的△H___0(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是_______。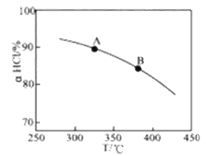
②在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由______________。
③下列措施中有利于提高aHCl的有___________。
A、增大n(HCl) B、增大n(O2)
C、使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率______(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学方程式______________。