题目内容
16.图中I是氢氧燃料电池的示意图,某同学想在II中实现Fe上镀铜,下列说法正确的是( )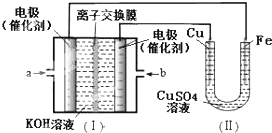
| A. | a处通入O2 | B. | b处发生氧化反应 | ||
| C. | 电流由Cu电极移向b | D. | Fe电极发生的反应为:Cu2++2e-=Cu |
分析 Fe上镀铜时,Fe作阴极,接电源的负极,氢氧燃料电池中,氢气在负极失电子发生氧化反应,Cu作阳极,接电源的正极,即通入氧气的电极,据此分析.
解答 解:A、Fe上镀铜时,Fe作阴极,所以a处通入氢气,故A错误;
B、b处通入氧气,氧气在正极发生还原反应,故B错误;
C、a为负极b为正极,电流从正极经外电路流向负极,电流从b电极流向Cu,故C错误;
D、Fe为阴极,电极反应式为Cu2++2e-=Cu,故D正确;
故选D.
点评 本题考查原电池和电解池的知识,题目难度中等,解答此种类型的题目的关键是能把握电化学原理,能正确书写电极反应式.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
2.FeCl3和CuCl2的混合溶液中加入a g铁粉,待溶液完全变为浅绿色时,滤出不溶物,经干燥后得其质量也是a g,则原溶液中FeCl3和CuCl2的物质的量比是( )
| A. | 1:7 | B. | 2:1 | C. | 2:7 | D. | 7:2 |
7.丙烷高温裂解生成甲烷和乙烯两种物质.现取丙烷裂解混和物1L充分燃烧后生成相同状况下的二氧化碳为2.25L,则丙烷裂解的百分率是( )
| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
8.(双选)下列实验操作和对应的现象、结论都正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | Al2(SO4)3溶液中滴加过量Ba(OH)2 | 生成白色沉淀物 | Al(OH)3不溶于Ba(OH)2 |
| B | 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 | 试纸变蓝 | NO2具有氧化性 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中可能含有SO42- |
| D | 向CuCl2和MgCl2混合溶液中加入过量的NaOH溶液 | 产生蓝色沉淀 | NaOH不和MgCl2反应 |
| A. | A | B. | B | C. | C | D. | D |
5.下列溶液或浊液中,说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值增大 | |
| B. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1 和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O=Na2CO3+2HClO | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| D. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) |
6.向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是( )
| A. | 氯气:K+、Na+、SiO32-、NO3- | B. | 二氧化硫:Na+、NH4+、SO32-、C1- | ||
| C. | 氨气:K+、Na+、AlO2-、CO32- | D. | 乙烯:H+、K+、MnO4-、SO42- |
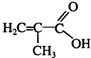 +C16H33OH$→_{△}^{浓硫酸}$
+C16H33OH$→_{△}^{浓硫酸}$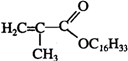 +H2OE+K→J
+H2OE+K→J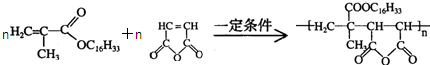
 .
. .
.