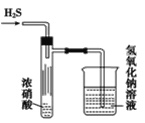
题目内容
【题目】(I)常温下,回答下列问题:(提示:lg2 = 0.3)
(1)pH=4的硫酸溶液中,由水电离出的氢离子浓度为____________________________;
(2)将pH=11的氢氧化钡稀释105倍后pH为____________________________________;
(3)将pH=11的氨水稀释100倍后pH范围为___________________________________;
(4)将pH=2的盐酸与pH=5的硫酸等体积混合后pH为__________________________;
(5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,且a+b=13,则V酸:V碱=________。
(II)反应A(s)+2B(g)2C(g)在密闭容器中达到平衡。
(1)若升高温度能使C的物质的量减小,则正反应是___(填“吸热”或“放热”)反应。
(2)若增加A的物质的量,平衡________(填“正向”或“逆向”或“不”)移动。
(3)若增大压强,平衡________(填“正向”或“逆向”或“不”)移动。
(4)若增加C的浓度,B(g)的转化率________(填“增大”、“减小”或“不变”)。
【答案】1.0×10-10mol/L 无限接近7但大于7 9<pH<11 2.3 0.1 放热 不 不 减小
【解析】
(I)(1)常温下,pH=4的硫酸溶液中,c(H+)=10-4mol/L,根据水的离子积常数计算氢氧根的浓度,再结合溶液中的氢氧根全部是由水电离产生的,而水电离出的氢离子与水电离出的氢氧根相等进行计算;
(2)强碱溶液每稀释10倍时,溶液的pH减小1,将pH=11的氢氧化钡稀释105倍后,pH不可能变为6,此时不能忽略水的电离,溶液接近中性,则pH无限接近7但大于7;
(3)若为pH=11的强碱溶液稀释100倍,则pH变为9,但是氨水属于弱碱,稀释促进电离,氢氧根物质的量增大,因此碱性应稍大些,所以比9大,但毕竟加了水,溶液变稀,氢氧根的浓度减小,则pH小于11;
(4)根据混合前后氢离子物质的量不变进行计算;
(5)强酸与强碱混合显中性,说明氢离子物质的量等于氢氧根物质的量,据此列出等式进行计算;
(II)(1)若升高温度能使C的物质的量减小,则平衡向逆反应方向移动,而升温反应向吸热方向移动,则正反应是放热反应;
(2)A为固体,增加A的物质的量,对平衡移动无影响;
(3)增大压强,平衡向气体体积减小的方向移动,而该反应前后气体体积不变,则平衡不移动。
(4)增加C的浓度,平衡逆向移动。
(I)(1)常温下,pH=4的硫酸溶液中,c(H+)=10-4mol/L,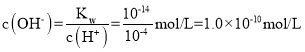 ,溶液中的氢氧根全部是由水电离产生的,水电离出的氢离子与水电离出的氢氧根相等,则由水电离出的氢离子c(H+)水=c(OH-)水=1.0×10-10mol/L;
,溶液中的氢氧根全部是由水电离产生的,水电离出的氢离子与水电离出的氢氧根相等,则由水电离出的氢离子c(H+)水=c(OH-)水=1.0×10-10mol/L;
故答案为:1.0×10-10mol/L;
(2)强碱溶液每稀释10倍时,溶液的pH减小1,将pH=11的氢氧化钡稀释105倍后,溶液接近中性,则pH无限接近7但大于7;
故答案为:无限接近7但大于7;
(3)强碱溶液每稀释10倍时,溶液的pH减小1,若为pH=11的强碱溶液稀释100倍,则pH变为9,但是氨水属于弱碱,稀释促进电离,氢氧根物质的量增大,因此碱性应稍大些,所以比9大,但毕竟加了水,溶液变稀,氢氧根的浓度减小,则pH小于11;
故答案为:9<pH<11;
(4)假设盐酸和硫酸各1L,则混合后![]() ,
,
![]() ;
;
故答案为:2.3;
(5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,则c(H+)V酸=c(OH-)V碱,则10-aV酸=10b-14 V碱,则![]() ;
;
故答案为:0.1;
(II)(1)若升高温度能使C的物质的量减小,则平衡向逆反应方向移动,而升温反应向吸热方向移动,则正反应是放热反应;
故答案为:放热;
(2)A为固体,增加A的物质的量,平衡不移动;
故答案为:不;
(3)增大压强,平衡向气体体积减小的方向移动,而该反应前后气体体积不变,则平衡不移动;
故答案为:不;
(4)增加C的浓度,平衡逆向移动,则B(g)的转化率减小;
故答案为:减小。

 53天天练系列答案
53天天练系列答案【题目】I.2017年5月5日,中国首架按照国际标准研制的拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。
N2(g)+2CO2(g)△H<0。
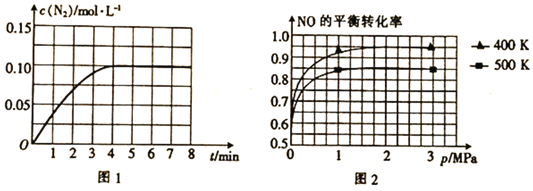
(1)若将1mol NO和2mol CO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=__________,4min末CO的浓度为__________mol·L-1。
(2)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置中比较适合的温度和压强是__________
II.取50 mL0.50mol·L-1NaOH溶液和50 mL、0.50mol/L硫酸溶液进行中和热测定实验,实验数据如下表:
(1)请填写表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 31.4 | |
(2)近似认为0.50mol·L-1 NaOH 溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c =4.18J·g-1·℃-1。则中和热△H=__________。(取小数点后一位)
(3)上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
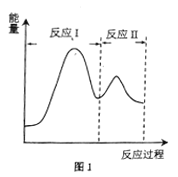
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。