题目内容
【题目】I.布朗斯特(Brnsted)和劳莱(Lowry)的质子理论认为,凡是给出质子(H+)的任何物质(分子或离子)都是酸;凡是接受质子(H+)的任何物质都是碱。简单地说,酸是质子的给予体,而碱是质子的接受体。酸和碱之间的关系表示如:酸![]() 质子(H+)+ 碱
质子(H+)+ 碱
(1)根据酸碱质子理论,既能看成酸又能看成碱的是_____________。(均填序号)
①![]() ②HS- ③
②HS- ③![]() ④H2O ⑤H3O+ ⑥Na+
④H2O ⑤H3O+ ⑥Na+
(2)已知反应C6H5OH + ![]() =C6H5O - +
=C6H5O - +![]() ,则C6H5O – 和
,则C6H5O – 和![]() -碱性较强的是__________。
-碱性较强的是__________。
Ⅱ.(3)水的离子积常数为Kw ,弱酸HA的电离平衡常数为Ka,NaA的溶液中A-的水解平衡常数为Kh ,根据它们的平衡常数表达式判断,Ka与Kh的关系为__________________。
(4)已知常温下弱酸HA的电离平衡常数为K=1.75× 10-5,常温下向0.2mol/L的HA的溶液中加入等体积0.1mol/L的NaOH溶液,该溶液pH值___7(填“>”或 “=”或 “<”),该溶液粒子浓度关系正确的是____。
A.2c(Na+)> c(HA)+c(A-)
B.c(A-)—c(HA)=2[c(H+)—c(OH-)]
C.c(A-)> c(Na+)> c(HA)> c(H+)>c(OH-)
D.c(Na+)>c(A-)> c(HA)>c(H+)> c(OH-)
【答案】②④ ![]() Ka ˙Kh = Kw < BC
Ka ˙Kh = Kw < BC
【解析】
(1)根据酸碱质子理论进行分析;
(2)根据离子结合氢离子的能力强弱判断碱性的强弱;
(3)弱酸HA的电离及A-水解的电离平衡常数判断;
(3)利用水解平衡常数Kh=![]() 计算及判断。
计算及判断。
(1)①CO32-只能结合氢离子,生成CO2,不能给出氢离子,故①错误;
②HS-能接受氢离子变成H2S,能给出氢离子变成S2-,所以既是酸又是碱,故②正确;
③NH4+能给出氢离子变成氨气,不能接受氢离子,属于酸,故③错误;
④H2O能接受氢离子变成H3O+,能给出氢离子变成OH-,所以既是酸又是碱,故④正确;
⑤H3O+能给出氢离子变成氨气,不能接受氢离子,属于酸,故⑤错误;
⑥Na+既不能接受氢离子,也不能给出氢离子,所以既不是酸又不是碱,故⑥错误;
答案选②④;
(2)已知反应C6H5OH + ![]() =C6H5O - +
=C6H5O - +![]() ,则
,则![]() 结合H+的能力强于C6H5O – ,故碱性较强的是
结合H+的能力强于C6H5O – ,故碱性较强的是![]() ;
;
(3)弱酸HA的电离方程式为:HA![]() H++A-,根据电离方程式可知,Ka=
H++A-,根据电离方程式可知,Ka=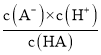 ,A-水解的反应方程式为:A-+H2O
,A-水解的反应方程式为:A-+H2O![]() HA+OH-,根据水解方程式可知,Kh=
HA+OH-,根据水解方程式可知,Kh=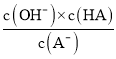 ,则Ka×Kh=c(H+)×c(OH-)=Kw,故答案为:Ka·Kh = Kw;
,则Ka×Kh=c(H+)×c(OH-)=Kw,故答案为:Ka·Kh = Kw;
(4)常温下向0.2mol/L的HA的溶液中加入等体积0.1mol/L的NaOH溶液,二者反应后得到等物质的量浓度的HA和NaA的混合溶液,根据物料守恒得c(HA)+c(A-)=![]() =0.1mol/L;根据上述分析可知,A-的水解平衡常数Kh=
=0.1mol/L;根据上述分析可知,A-的水解平衡常数Kh=![]() =
=![]() =5.7×10-10 < Ka,说明HA的电离程度大于A-的水解程度,溶液呈酸性,则pH<7;
=5.7×10-10 < Ka,说明HA的电离程度大于A-的水解程度,溶液呈酸性,则pH<7;
A.因两溶液混合后得到的是等物质的量浓度的HA和NaA的混合溶液,根据物料守恒得2c(Na+)= c(HA)+ c(A-),选项A错误;
B. 根据物料守恒得2c(Na+)= c(HA)+ c(A-),根据电荷守恒得c(Na+)+ c(H+)= c(OH-)+ c(A-),将两式合并得:c(A-)-c(HA)=2[c(H+)-c(OH-)],选项B正确;
C. 根据上述分析可知,HA的电离程度大于A-的水解程度,溶液呈酸性,根据电荷守恒可知c(A-)>c(Na+),c(A-)> c(Na+)> c(HA)> c(H+)> c(OH-),选项C正确;
D. 因HA的电离程度大于A-的水解程度,溶液呈酸性,则c(A-)> c(Na+)> c(HA)> c(H+)> c(OH-),选项D错误;
答案选BC。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案