题目内容
室温下,对于醋酸及其盐的下列判断正确的是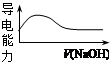
| A.稀醋酸溶解石灰石的离子方程式为 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
| C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图 |
| D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同 |
B
解析试题分析:醋酸是弱酸,电离方程式中应写出化学式,故A错误;醋酸是弱电解质,氢氧化钠和醋酸反应生成醋酸钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故C错误;CH3COONH4是弱酸弱碱盐,促进水的电离,醋酸根和铵根离子水解程度相同,故溶液显中性,K2SO4是强酸强碱盐,对水的电离程度没有影响,故D错误。
考点:考查离子方程式的正误判断。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将pH=5的H2SO4溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为( )
| A.1:10 | B.1:1 | C.1:2 | D.1:20 |
下列说法正确的是( )
| A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0 |
| C.工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中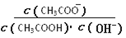 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) |
| B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: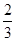 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸): |
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
下列说法正确的是
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA |
| C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑ |
| D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是( )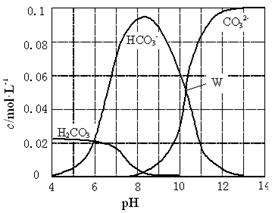
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
 H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是