题目内容
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是( )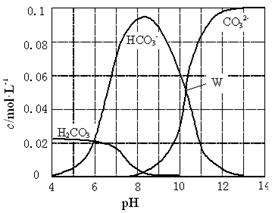
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
B
解析试题分析:A、根据电荷守恒可知,溶液中离子应该满足关系式c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-),故A错误;B、pH=4,说明反应中有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 mol?L-1,故B正确;C、根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)=c(Cl-)= c(Na+),则c(H+)+2c(H2CO3)+2c(HCO3-)=c(OH-)+c(Cl-),故C错误;D、根据图象可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32-)>c(Cl-)>c(HCO3-)>c(H2CO3),故D错误;故选B。
c(Na+),则c(H+)+2c(H2CO3)+2c(HCO3-)=c(OH-)+c(Cl-),故C错误;D、根据图象可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32-)>c(Cl-)>c(HCO3-)>c(H2CO3),故D错误;故选B。
考点:考查碳酸钠和盐酸反应中离子浓度大小比较

 名校课堂系列答案
名校课堂系列答案室温下,对于醋酸及其盐的下列判断正确的是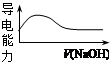
| A.稀醋酸溶解石灰石的离子方程式为 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大 |
| C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图 |
| D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同 |
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )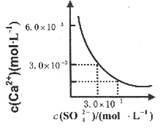
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大 |
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是
| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
25℃时,向20.00mLNaOH溶液中逐滴加入0.20mo1·L-l的CH3COOH溶液得到如图曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.c点时恰好中和 |
| C.在d~e之间存在如下关系:C(Na十)>c(CH3COO-)>c(H十)>c(OH一) |
| D.e点时溶液中溶质是CH3COONa和CH3COOH |
某混合溶液中所含离子的浓度如下表,则M离子可能为
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量( )
| A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L |
| D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  ?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2- H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |