题目内容
2.磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到.
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)
②CaO(s)+SiO2(s)=CaSiO3(s)
③CO2(g)+C(s)=2CO(g)
已知:CaSiO3的熔点(1546℃)比SiO2低.
a、写出由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)制取白磷总的化学反应方程式2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+P4+10CO.
b、白磷(P4)是正四面体结构,请画出白磷(P4)的结构式
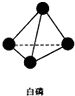 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体PH3(写化学式).
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得.工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在2.1~7.2之间 (已知磷酸的各级电离常数为:K1=7.1×10-3K2=6.3×10-8K3=4.2×10-13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6).Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是3Ca2++2HPO42-=Ca3(PO4)2↓+2H+ (用离子方程式表示).
分析 (1)a、依据热化学方程式和盖斯定律计算所需化学方程式;
b、白磷(P4)是正四面体结构,P-P间形成共价键;
(2)歧化反应磷元素升高为次磷酸盐,磷元素化合价为+1价,降低的只能为负价,则为氢化物;
(3)H3PO4?H++H2PO4-K1=7.1×10-3;H2PO4-?H++HPO42-K2=6.3×10-8;HPO42-?H++HPO43-K3=4.2×10-13;上一级电离产生的H+对下一级电离有抑制作用;为获得尽可能纯的NaH2PO4,需H2PO4-浓度最大,根据K1、K2、以及pH=-lgc(H+)计算;
若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性.
解答 解:(1)a、①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)△H1=+Q1kJ•mol-1
②CaO(s)+SiO2(s)=CaSiO3(s)△H2=-Q2 kJ•mol-1
③CO2(g)+C(s)=2CO(g)△H3=+Q3kJ•mol-1
依据热化学方程式和盖斯定律计算得到①×$\frac{1}{2}$+③+②×6得到化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+P4+10CO;
故答案为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;高温\;}}{\;}$6CaSiO3+P4+10CO;
b、白磷(P4)是正四面体结构,P-P间形成共价键,白磷(P4)的结构式 ,1mol白磷(P4)含有P-P键的数目为6NA,
,1mol白磷(P4)含有P-P键的数目为6NA,
故答案为: ;6NA;
;6NA;
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体,歧化反应磷元素升高为次磷酸盐,磷元素化合价为+1价,降低的只能为负价,则为氢化物PH3;
故答案为:PH3;
(3)为获得尽可能纯的NaH2PO4,需配制磷酸、磷酸二氢钠的缓冲溶液,当溶液全部为磷酸溶液时,磷酸以第一步电离为主,所以H3PO4?H++H2PO4-K1=7.1×10-3;PH=-lgc(H+)=3-lg7.1≈2.1,
当溶液全部为NaH2PO4溶液时,H2PO4-?H++HPO42-K2=6.3×10-8,所以pH=-lgc(H+)=8-lg6.3≈7.2,
所以pH应控制介于2.1~7.2之间;HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性;
故答案为:2.1~7.2;3Ca2++2HPO42-=Ca3(PO4 )2↓+2H+.
点评 本题考查酸碱混合的定性判断和计算,氧化还原反应电子转移计算,溶液的配制PH计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握图象所给信息,为解答该题的关键,题目难度中等.

| A. | 用分液法分离碘酒和CCl4 | |
| B. | 用饱和碳酸钠溶液萃取乙醇中的乙酸 | |
| C. | 用银氨溶液鉴别甲酸乙酯和乙醛 | |
| D. | 用浓溴水鉴别苯和环己烯 |
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中每生成5.7g AlON的同时生成1.12 L CO | |
| C. | 反应中氮气作氧化剂 | |
| D. | 反应中氧化产物和还原产物的物质的量之比是2:1 |
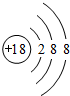
| A. | 18O是氧元素的一种核素,它的中子数是8 | |
| B. | O4和O2是互为同位素 | |
| C. | 同温同压下,等体积的O4气体和O2含有相同的分子数 | |
| D. | O4转化O2为物理性质 |
| A. | 流水、风力是一次能源,电力、蒸汽是二次能源 | |
| B. | 普通锌锰电池是一次电池,碱性锌锰电池是二次电池 | |
| C. | 铅蓄电池是一次电池,氢氧燃料电池是二次电池 | |
| D. | 同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
| A. | 100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 | |
| B. | 常温下,pH=1的HF溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | 常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
 .
. ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.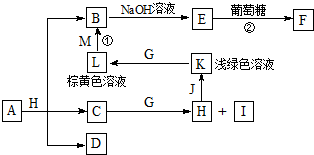 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.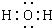 .
.