题目内容
20.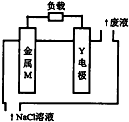 锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )
锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )| A. | 该电池工作时,电子沿M→电解液→Y电极流动 | |
| B. | 若M为铝,则该电池工作时溶液的pH将不断增大 | |
| C. | 若M为镁,则该电池反应的化学方程式为2Mg+O2=2MgO | |
| D. | 若M为铁,则该电池工作时负极发生的反应为Fe-2e-=Fe2+ |
分析 该原电池中,金属失电子发生氧化反应,所以M为负极、Y为正极,
A.放电时,导致从负极沿导线流向正极;
B.若M为铝,发生吸氧腐蚀,电池反应式为4Al+3O2+6H2O=4Al(OH)3;
C.若M为Mg,发生吸氧腐蚀,电池反应式为2Mg+O2+H2O=2Mg(OH)2;
D.若M为铁,发生吸氧腐蚀,负极上Fe失电子发生氧化反应.
解答 解:A.该装置是原电池,M易失电子发生氧化反应为负极,则Y为正极,电子沿M→负载→Y电极流动,故A错误;
B.若M为铝,则电池反应的化学方程式为4Al+3O2+6H2O=4Al(OH)3,溶液的pH不变,故B错误;
C.若M为镁,则该电池反应的化学方程式为2Mg+O2+H2O=2Mg(OH)2,溶液的pH不变,故C错误;
D.若M为铁,发生吸氧腐蚀,负极上Fe失电子发生氧化反应,负极发生的反应为Fe-2e-=Fe2+,故D正确;
故选D.
点评 本题考查化学电源新型电池,侧重考查原电池原理,明确各个电极上发生的电极反应是解本题关键,会书写电极反应式,易错选项是A,注意电解质溶液是利用阴阳离子定向移动形成电流的,电子不加入电解质溶液.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
10.下列物质的分离和鉴别方法正确的是( )
| A. | 用分液法分离碘酒和CCl4 | |
| B. | 用饱和碳酸钠溶液萃取乙醇中的乙酸 | |
| C. | 用银氨溶液鉴别甲酸乙酯和乙醛 | |
| D. | 用浓溴水鉴别苯和环己烯 |
11.下列说法正确的是( )
| A. | 流水、风力是一次能源,电力、蒸汽是二次能源 | |
| B. | 普通锌锰电池是一次电池,碱性锌锰电池是二次电池 | |
| C. | 铅蓄电池是一次电池,氢氧燃料电池是二次电池 | |
| D. | 同周期元素形成的简单离子中,原子序数越大的离子半径越小 |
8.胡妥油(D)用作香料的原料,它可由A合成得到:
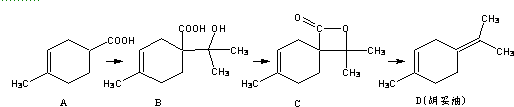
下列说法正确的是( )

下列说法正确的是( )
| A. | 1molA可与2molNaOH完全反应 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
5.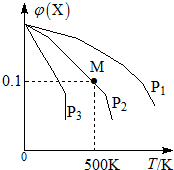 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
 某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )
某可逆反应为2X(g)═3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )| A. | 升高温度,该反应平衡常数K减小 | B. | 压强大小有P3>P2>P1 | ||
| C. | 平衡后加入高效催化剂使Mr增大 | D. | 在该条件下M点X平衡转化率为$\frac{9}{11}$ |
12.下列各组数据中比值不为1:1的是( )
| A. | 100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 | |
| B. | 常温下,pH=1的HF溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | 常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
9.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,11.2L乙醇完全燃烧所生成的气态产物的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5摩尔硅中含有的化学键数目为NA | |
| D. | 1 mo CH3+所含的电子总数为8NA |