ЬтФПФкШн
ЁОЬтФПЁПФмдДЪЧЯжДњЮФУїЕФдЖЏСІЃЌЭЈЙ§ЛЏбЇЗНЗЈПЩвдЪЙФмСПАДШЫУЧЫљЦкЭћЕФаЮЪНзЊЛЏЃЌДгЖјПЊБйаТФмдДКЭЬсИпФмдДЕФРћгУТЪЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
ЃЈ1ЃЉЂйЙЄвЕКЯГЩАБЗДгІЃКN2+3H2![]() 2NH3ЪЧЗХШШЕФПЩФцЗДгІЃЌЗДгІЬѕМўЪЧИпЮТЁЂИпбЙЃЌВЂЧвашвЊКЯЪЪЕФДпЛЏМСЁЃвбжЊ1molN2ЭъШЋЗДгІЩњГЩNH3ПЩЗХГі92kJШШСПЁЃШчЙћНЋ10molN2КЭзуСПH2ЛьКЯЃЌЪЙЦфГфЗжЗДгІЃЌЗХГіЕФШШСП___ЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉ920kJЁЃ
2NH3ЪЧЗХШШЕФПЩФцЗДгІЃЌЗДгІЬѕМўЪЧИпЮТЁЂИпбЙЃЌВЂЧвашвЊКЯЪЪЕФДпЛЏМСЁЃвбжЊ1molN2ЭъШЋЗДгІЩњГЩNH3ПЩЗХГі92kJШШСПЁЃШчЙћНЋ10molN2КЭзуСПH2ЛьКЯЃЌЪЙЦфГфЗжЗДгІЃЌЗХГіЕФШШСП___ЃЈЬюЁАДѓгкЁБЁЂЁАаЁгкЁБЛђЁАЕШгкЁБЃЉ920kJЁЃ
ЂквбжЊЖЯПЊ1molN![]() NМќЮќЪеЕФФмСПЮЊ945.6kJЃЌаЮГЩ1molNЉHМќЗХГіЕФФмСПЮЊ391kJЃЌИљОнЛЏбЇЗНГЬЪНN2+3H2
NМќЮќЪеЕФФмСПЮЊ945.6kJЃЌаЮГЩ1molNЉHМќЗХГіЕФФмСПЮЊ391kJЃЌИљОнЛЏбЇЗНГЬЪНN2+3H2![]() 2NH3ЃЌЩњГЩБъзМзДПіЯТ44.8LNH3ЪБЗХГіЕФФмСПЮЊ92.4kJЃЌдђЖЯПЊ1molHЉHМќЮќЪеЕФФмСПЪЧ___ЁЃ
2NH3ЃЌЩњГЩБъзМзДПіЯТ44.8LNH3ЪБЗХГіЕФФмСПЮЊ92.4kJЃЌдђЖЯПЊ1molHЉHМќЮќЪеЕФФмСПЪЧ___ЁЃ
ЃЈ2ЃЉФГЪЕбщаЁзщЭЌбЇНјааШчЭМ1ЫљЪОЪЕбщЃЌвдМьбщЛЏбЇЗДгІжаЕФФмСПБфЛЏЁЃЧыИљОнФуеЦЮеЕФЗДгІдРэХаЖЯЃЌЂкжаЕФЮТЖШ___ЃЈЬюЁАЩ§ИпЁБЛђЁАНЕЕЭЁБЃЉЁЃЗДгІЙ§ГЬ___ЃЈЬюЁАЂйЁБЛђЁАЂкЁБЃЉЕФФмСПБфЛЏПЩгУЭМ2БэЪОЁЃ
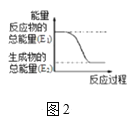
ЃЈ3ЃЉвбжЊЛЏбЇЗДгІA2ЃЈgЃЉ+B2ЃЈgЃЉЈT2ABЃЈgЃЉЕФФмСПБфЛЏШчЭМ2ЫљЪОЃЌИУЗДгІЪЧ___ЃЈЬюЁАЮќШШЁБЛђЁАЗХШШЁБЃЉЗДгІЁЃ
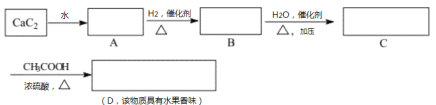
ЃЈ4ЃЉгУCH3OHКЭO2зщКЯаЮГЩЕФжЪзгНЛЛЛФЄШМСЯЕчГиЕФНсЙЙШчЭМ3ЫљЪОЃК
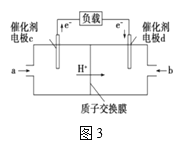
ЂйдђdЕчМЋЪЧ___ЃЈЬюЁАе§МЋЁБЛђЁАИКМЋЁБЃЉЃЌcЕчМЋЕФЕчМЋЗДгІЪНЮЊ___ЁЃ
ЂкШєЯпТЗжазЊвЦ2molЕчзгЃЌдђИУШМСЯЕчГиРэТлЩЯЯћКФЕФO2дкБъзМзДПіЯТЕФЬхЛ§ЮЊ___LЁЃ
ЁОД№АИЁПаЁгк 436kJ НЕЕЭ Ђй ЗХШШ е§МЋ 2CH3OH+2H2O-12e-=2CO2+12H+ 11.2
ЁОНтЮіЁП
(2)ЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЌБэЪОЕФЪЧЗХШШЗДгІЃЛ
(3)ЕчзгСїШыЕФЕчМЋЪЧе§МЋЃЛМзЭщдкИКМЋЗЂЩњбѕЛЏЗДгІЩњГЩCO2ЃЌЛЏКЯМлДг-2Щ§жС+4ЃЌвдДЫРДХфЦНЕчМЋЗДгІЪНЁЃ
(1)ЂйКЯГЩАБЪЧПЩФцЗДгІЃЌЗДгІЮяВЛФмЭъШЋзЊЛЏЮЊЩњГЩЮяЃЌЫљвдНЋ10molN2КЭзуСПH2ЛьКЯЃЌЪЙЦфГфЗжЗДгІЃЌЗХГіЕФШШСПаЁгк92kJЃЌЙЪД№АИЮЊЃКаЁгкЃЛ
ЂкБъзМзДПіЯТ44.8LNH3МД2mol NH3ЃЌЩшЖЯПЊ1molHЉHМќЮќЪеЕФФмСПЮЊx kJЃЌ![]() НтЕУx=436kJЃЌЙЪЖЯПЊ1molHЉHМќЮќЪеЕФФмСПЪЧ436kJЃЛ
НтЕУx=436kJЃЌЙЪЖЯПЊ1molHЉHМќЮќЪеЕФФмСПЪЧ436kJЃЛ
(2)ЭМ1жаЂкЪЧЧтбѕЛЏБЕОЇЬхКЭТШЛЏяЇЕФЗДгІЃЌЪЧЮќШШЗДгІЃЌЙЪЮТЖШЛсНЕЕЭЃЛЭМ2жаЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЌБэЪОЕФЪЧЗХШШЗДгІЃЌЗДгІЙ§ГЬЂйЪЧЛюЦУН№ЪєгыЫсЕФЗДгІЃЌЮЊЗХШШЗДгІЃЌМДЗДгІЙ§ГЬЂйгУЭМ2БэЪОЃЛЙЪД№АИЮЊЃКНЕЕЭЃЛЂйЃЛ
(3)ЭМ2жаЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЌБэЪОЕФЪЧЗХШШЗДгІЃЌЙЪД№АИЃКЗХШШЃЛ
(4)ЂйdЕчМЋЪЧЕчзгСїШыЃЌЫЕУїdЕчМЋЪЧе§МЋЃЛЕчМЋcЪЧИКМЋЃЌМзЭщдкИКМЋЗЂЩњбѕЛЏЗДгІЩњГЩCO2ЃЛЦфЕчМЋЗДгІЪНЮЊ2CH3OH+2H2O-12e-=2CO2+12H+ЃЌЙЪД№АИЮЊЃКе§МЋЃЛ2CH3OH+2H2O-12e-=2CO2+12H+ЃЛ
ЂкИУЕчГие§МЋЗДгІЪНЮЊЃКO2+4H++4e-=2H2OЃЌЯпТЗжазЊвЦ2molЕчзгЃЌдђИУШМСЯЕчГиРэТлЩЯЯћКФЕФO2дкЮяжЪЕФСПЮЊ0.5molЃЌБъзМзДПіЯТЕФЬхЛ§ЮЊ0.5molЁС22.4L/mol=11.2LЃЌЙЪД№АИЮЊЃК11.2ЁЃ

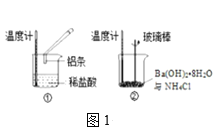
ЁОЬтФПЁПЪЕбщаЁзщЮЊбщжЄNO2гыЫЎЗДгІЕФВњЮяЃЌгУШчЭМЫљЪОзАжУНјааЪЕбщЃЈМаГжзАжУвбТдШЅЃЌЦјУмадвбМьбщЃЉЁЃ

ЃЈЪЕбщЙ§ГЬЃЉ
ЪЕбщВНжш | ЪЕбщЯжЯѓ |
ЂёЃЎДђПЊK1ЁЂK3ЁЂK5ЃЌЙиБеK2ЁЂK4ЃЌЭЈШы вЛЖЮЪБМфN2ЃЌЙиБеK1 | _________ |
ЂђЃЎДђПЊK2ЃЌЗХШызуСПХЈHNO3ЃЌЭЌЪБДђПЊpHДЋИаЦїКЭNO3ЈDДЋИаЦїЃЌМЧТМЪ§Он | дВЕзЩеЦПжаЗДгІОчСвЃЌЭЦЌж№НЅШмНтЃЌШмвКБфЮЊРЖТЬЩЋЃЌ_________ЃЛЦЌПЬКѓЃЌШ§ОБЦПФкЕФЕМЙмПкгаЦјХнУАГі |
IIIЃЎ5minКѓЃЌДђПЊK4ЃЌгУзЂЩфЦїНЋЩйСПбѕЦјзЂШыШ§ОБЦПЃЌЙиБеK4 | Ш§ОБЦПФкЕФЦјЬхДгЮоЩЋБфЮЊЧГКьзиЩЋ |
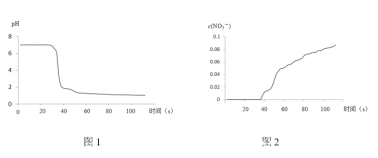
ВНжшIIжаЃЌДЋИаЦїМЧТМЪ§ОнШчЭМЫљЪОЃК
ЃЈНтЪЭМАНсТлЃЉ
ЃЈ1ЃЉNO2гыЫЎЗДгІЕФРызгЗНГЬЪНЮЊ____________ ЁЃ
ЃЈ2ЃЉВНжшIжаЃЌЭЈШыN2ЕФФПЕФЪЧ____________ЁЃ
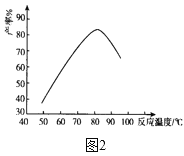
ЃЈ3ЃЉНЋВНжшIIжадВЕзЩеЦПФкЕФЪЕбщЯжЯѓВЙГфЭъећЃК____________ЁЃ
ЃЈ4ЃЉИУЪЕбщбщжЄNO2гыЫЎЗДгІВњЮяЕФЪЕбщжЄОнАќРЈ____________ЃЈЬюађКХЃЉЁЃ
A.дВЕзЩеЦПжаШмвКБфЮЊРЖТЬЩЋ
B.Ш§ОБЦПФкЕФЦјЬхДгЮоЩЋБфЮЊЧГКьзиЩЋ
C.pHДЋИаЦїМЧТМЫљЕУЪ§Он
D.![]() ДЋИаЦїМЧТМЫљЕУЪ§Он
ДЋИаЦїМЧТМЫљЕУЪ§Он
ЃЈ5ЃЉгаЭЌбЇШЯЮЊИУЪЕбщВЛбЯНїЃЌвђЮЊвВПЩФмЕМжТДЋИаЦїЫљМЧТМЕФЪ§ОнНсЙћ____________