题目内容
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
B
解析试题分析:H2O2、SO2都有还原性,酸性高锰酸钾溶液都有强氧化性,H2O2、SO2能使酸性高锰酸钾褪色,涉及化合价的升降变化,不涉及二氧化硫的漂白性,则陈述II错误,故A 选项错误;根据原电池的构成条件,纯银器表面腐蚀不是电化学腐蚀,而是化学腐蚀,一般是银与硫化物反应生成硫化银,则陈述I、II正确且有因果关系,故B选项正确;二氧化硅与强酸不反应,HF是唯一能与之反应的弱酸,且生成物不是盐和水,因此二氧化硅不是两性氧化物,而是酸性氧化物,则陈述I正确,但陈述II错误,故C选项错误;饱和硫酸钡溶液中存在如下平衡:BaSO4(s)  Ba2++SO42-,当加入饱和碳酸钠溶液时,碳酸根离子与钡离子结合生成碳酸钡沉淀,减小钡离子浓度,使硫酸钡沉淀溶解平衡右移,则硫酸钡沉淀转化为碳酸钡沉淀,但是不能判断两种沉淀溶度积的大小,故D选项错误。
Ba2++SO42-,当加入饱和碳酸钠溶液时,碳酸根离子与钡离子结合生成碳酸钡沉淀,减小钡离子浓度,使硫酸钡沉淀溶解平衡右移,则硫酸钡沉淀转化为碳酸钡沉淀,但是不能判断两种沉淀溶度积的大小,故D选项错误。
考点:考查考生正确判断、解释和说明有关化学现象和问题的能力;考查考生对常见无机物及其应用的了解,着重考查考生对SO2的还原性和漂白性、H2O2的还原性、酸性高锰酸钾溶液的强氧化性、电化学腐蚀和化学腐蚀的条件、SiO2的性质与类别、沉淀的转化、溶度积大小关系的了解。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案下列说法正确的是
| A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物是
| A.NaCl和O2 | B.NaClO3和NaClO | C.NaClO3和Cl2 | D.NaClO3和NaCl |
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应:
①Si(s)+3HCl(g) 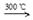 SiHCl3(g)+H2(g) +381 kJ
SiHCl3(g)+H2(g) +381 kJ
②SiHCl3(g)+H2(g) 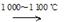 Si(s)+3HCl(g)
Si(s)+3HCl(g)
对上述两个反应的叙述中,错误的是
| A.两个反应都是置换反应 | B.反应②是吸热反应 |
| C.两个反应互为可逆反应 | D.两个反应都是氧化还原反应 |
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
| A.未知物质X为CO2,属于氧化产物 |
| B.每转移1mol e-时,生成2mol X |
| C.反应中PdCl2作氧化剂,被还原 |
| D.还原性:CO>Pd |
a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质的量之比为
A.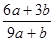 | B.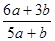 | C.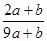 | D.不能确定 |
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L |
| B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) |
| D.原溶液中c(Br-)=0.4mol/L |
从海水中可以提取溴,主要反应为:2Br-+Cl2===2Cl-+Br2。下列说法正确的是( )
| A.溴离子具有氧化性 | B.氯气是还原剂 |
| C.该反应属于复分解反应 | D.氯气的氧化性比溴单质强 |