题目内容
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L |
| B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) |
| D.原溶液中c(Br-)=0.4mol/L |
B
解析试题分析:还原性强弱:I-﹥Fe2+﹥Br-,在FeBr2溶液中,通入Cl2过程中,Fe2+先反应,反应完之后是Br-。n(Cl2)=0.05mol,反应后有Br-,说明Cl2已全部反应完。n(Cl-)=0.1mol。c(Cl-)="0.1" mol/L,V(aq)=1L 。
所以,溶液中含有的n(Br-)=0.3mol。若溶液中Br-并没参加反应,则有Fe2+部分反应或者是恰好反应完。则n(FeBr2)=0.15mol,n(Fe2+)="0.15mol," 通入0.05mol Cl2后,反应掉n(Fe2+)="0.1" mol,生成n(Fe3+)="0.1" mol,剩余n(Fe2+)="0.05" mol。故B正确。
考点:氧化还原反应的计算及规律(优先律)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br-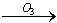 BrO-
BrO-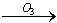 BrO2-
BrO2-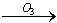 BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是
| A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理 |
| B.若改用氧气消毒,可避免生成溴酸盐 |
| C.BrO- 3氧化性比O3强 |
| D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生 |
下列物质性质的比较,正确的是
| A.热稳定性:Na2CO3>NaHCO3>H2CO3 |
| B.熔点:K>Na>Li |
| C.同条件下,同浓度溶液的pH值:NaHCO3>Na2CO3 |
| D.还原性:S2->Br->I- |
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
下列物质的用途,应用了氧化还原反应的是
| A.用食醋除去热水瓶胆壁上的水垢 | B.用次氯酸钠溶液消毒浴池 |
| C.盐卤用于制豆腐 | D.用小苏打发酵面团制作馒头 |
除废气NO的反应原理为:2CO+2NO=N2+2CO2有关该反应的说法不正确的是 ( )
| A.反应中CO为氧化剂 |
| B.反应中NO被还原 |
| C.在反应生成1 mol N2时,转移的电子为4 mol |
| D.CO和NO都是无色有毒气体 |