题目内容
A、B为两种短周期元素,A的原子序数大于B,B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学中常见的化合物,该化合物熔融时能导电。试回答下列问题:
(1)A、B的元素符号分别是___________、_____________。
(2)用电子式表示A、B元素形成化合物的过程:?__________________________________。
(3)A、B所形成的化合物的晶体结构跟NaCl的晶体结构相似,则每个阳离子周围吸引了_________个阴离子,晶体中阴、阳离子个数之比为_________。
(4)A、B所形成的化合物的晶体的熔点比NaF晶体的熔点___________(填“高”或“低”)。判断的理由是__________________________________________________________________。
(1)A、B的元素符号分别是___________、_____________。
(2)用电子式表示A、B元素形成化合物的过程:?__________________________________。
(3)A、B所形成的化合物的晶体结构跟NaCl的晶体结构相似,则每个阳离子周围吸引了_________个阴离子,晶体中阴、阳离子个数之比为_________。
(4)A、B所形成的化合物的晶体的熔点比NaF晶体的熔点___________(填“高”或“低”)。判断的理由是__________________________________________________________________。
(1)Mg O

(3)6 1︰1
(4)高 Mg2+、O2-与对应的Na+、F-半径相差不大,但Mg2+、F-所带电荷数多,形成离子键较强,故熔点较高

(3)6 1︰1
(4)高 Mg2+、O2-与对应的Na+、F-半径相差不大,但Mg2+、F-所带电荷数多,形成离子键较强,故熔点较高
该化合物在熔融时能导电,说明其为离子晶体,又因为A、B为两种短周期元素,且A的原子序数大于B,故推出A为Mg,B为O,其电子式为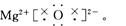

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目