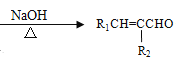
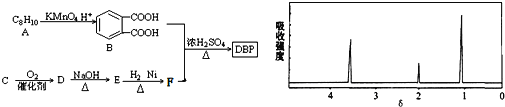
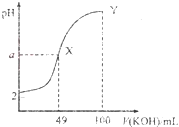
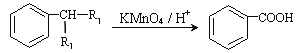题目内容
【题目】设![]() 为阿伏伽德罗常数的值.下列说法正确的是( )
为阿伏伽德罗常数的值.下列说法正确的是( )
A.2L![]() 亚硫酸溶液中含有的
亚硫酸溶液中含有的![]() 离子数为
离子数为![]()
B.室温下,1L![]() 的NaOH溶液中,由水电离的
的NaOH溶液中,由水电离的![]() 离子数目为
离子数目为![]()
C.标准状况下,46g![]() 气体的分子数为
气体的分子数为![]()
D.某密闭容器中盛有![]()
![]() 和
和![]()
![]() ,在一定条件下充分反应,转移电子的数目小于
,在一定条件下充分反应,转移电子的数目小于![]()
【答案】D
【解析】
A、亚硫酸是弱酸,不能完全电离;
B、![]() 的氢氧化钠溶液中,氢离子全部来自于水的电离;
的氢氧化钠溶液中,氢离子全部来自于水的电离;
C、46g ![]() 的物质的量为1mol,而二氧化氮中存在平衡:
的物质的量为1mol,而二氧化氮中存在平衡:![]() ;
;
D、合成氨的反应为可逆反应。
A、亚硫酸是弱酸,不能完全电离,故溶液中的氢离子的个数小于![]() 个,故A错误;
个,故A错误;
B、![]() 的氢氧化钠溶液中,氢氧根浓度为
的氢氧化钠溶液中,氢氧根浓度为![]() ,几乎全部来自氢氧化钠的电离,而氢离子的浓度为
,几乎全部来自氢氧化钠的电离,而氢离子的浓度为![]() 全部来自水的电离,由于水电离出的氢离子浓度和氢氧根的浓度相同,故此溶液中水电离出的氢氧根的浓度也为
全部来自水的电离,由于水电离出的氢离子浓度和氢氧根的浓度相同,故此溶液中水电离出的氢氧根的浓度也为![]() ,则物质的量为
,则物质的量为![]() ,个数为
,个数为![]() 个,故B错误;
个,故B错误;
C、46g ![]() 的物质的量为1mol,而中存在平衡:
的物质的量为1mol,而中存在平衡:![]() ,则导致分子个数减少,故分子个数小于
,则导致分子个数减少,故分子个数小于![]() 个,故C错误;
个,故C错误;
D、合成氨的反应为可逆反应,不能进行彻底,则转移的电子数小于![]() 个,故D正确;
个,故D正确;
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现