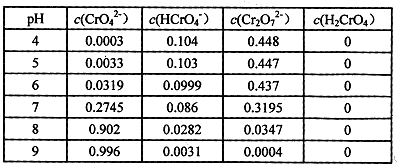
题目内容
下列有关溶液中粒子浓度的关系式中正确的是
- A.25℃时,0.1 mol·L-1pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-)
- B.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(H+) +c(Na+)=c(OH-)+2c(CO32-) +c(HCO3-)
- C.常温下,NH4Cl和NH3·H2O的混合溶液[pH=7,c(Cl-)=0.1mol/L]中:c(Cl-) > c(NH4+) > c(OH-) = c(H+)
- D.浓度均为0.1mol·L-1的CH3COONa和CH3COOH混合溶液:c(CH3COO-)—c(CH3COOH)= 2[c(H+) —2c(OH-)]
BD
pH=4.5的NaHC2O4溶液说明溶液显酸性,HC2O4-的电离大于水解,浓度c(C2O42-)>c(H2C2O4),A错误;B选项是溶液中的电荷守恒,正确;常温下NH4Cl和NH3·H2O的混合溶液[pH=7,溶液显中性,c(OH-) = c(H+),根据电荷守恒有c(Cl-)+c(OH-) = c(H+)+c(NH4+),所以c(Cl-) = c(NH4+),所以C错误;浓度均为0.1mol·L-1的CH3COONa和CH3COOH混合溶液,根据电荷守恒以及元素守恒可以得到c(CH3COO-)—c(CH3COOH)= 2[c(H+) —2c(OH-)],D正确;所以答案选BD。
pH=4.5的NaHC2O4溶液说明溶液显酸性,HC2O4-的电离大于水解,浓度c(C2O42-)>c(H2C2O4),A错误;B选项是溶液中的电荷守恒,正确;常温下NH4Cl和NH3·H2O的混合溶液[pH=7,溶液显中性,c(OH-) = c(H+),根据电荷守恒有c(Cl-)+c(OH-) = c(H+)+c(NH4+),所以c(Cl-) = c(NH4+),所以C错误;浓度均为0.1mol·L-1的CH3COONa和CH3COOH混合溶液,根据电荷守恒以及元素守恒可以得到c(CH3COO-)—c(CH3COOH)= 2[c(H+) —2c(OH-)],D正确;所以答案选BD。

练习册系列答案
相关题目

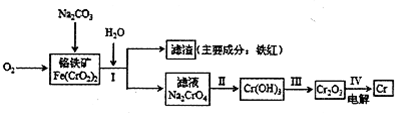
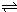 Cr2O72-+H2O
Cr2O72-+H2O