题目内容
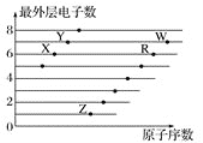
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3︰4,M原子的最外层电子数与次外层电子数之比为3︰4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻。请回答下列问题。
(1)M在元素周期表中的位置是___,写出Z的离子结构示意图:__;Q的简单氢化物的结构式为___。
(2)写出X、Y、R按原子个数之比1︰1︰1形成的化合物的化学式:___。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:___。
(4)写出单质R的一种工业用途:___。
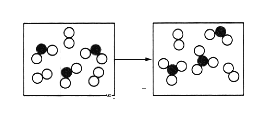
(5)如图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式:___。
(6)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式:___。
【答案】第三周期第ⅥA族 ![]()
![]() HClO 2H2O2
HClO 2H2O2![]() 2H2O+O2↑ 制漂白粉(或制漂白液、用于自来水消毒等) 2SO2+O2
2H2O+O2↑ 制漂白粉(或制漂白液、用于自来水消毒等) 2SO2+O2![]() 2SO3 NH5+H2O=NH3.H2O+H2↑
2SO3 NH5+H2O=NH3.H2O+H2↑
【解析】
元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3︰4,则Y为氧(O);M原子的最外层电子数与次外层电子数之比为3︰4,则M为硫(S);R-、Z+、X+离子半径逐渐减小,则R为氯(Cl)、Z为钠(Na)、X为氢(H);化合物XR常温下为气体,Q和Y在周期表中的位置相邻,则Q为氮(N)。
由以上分析可知,X、Q、Y、Z、M、R分别为H、N、O、Na、S、Cl。
(1)M为S,电子排布为2、8、6,在元素周期表中的位置是第三周期第ⅥA族,Z为Na,其离子结构示意图为![]() ;Q为N,其简单氢化物的结构式为
;Q为N,其简单氢化物的结构式为![]() 。答案为:第三周期第ⅥA族;
。答案为:第三周期第ⅥA族;![]() ;
;![]() ;
;
(2)X、Y、R分别为H、O、Cl,按原子个数之比1︰1︰1,形成的化合物的化学式为HClO。答案为:HClO;
(3)H与O可分别形成10电子分子H2O和18电子分子H2O2,该18电子分子H2O2转化成10电子分子H2O,发生的是双氧水的催化分解反应,化学方程式为2H2O2![]() 2H2O+O2↑
2H2O+O2↑
。答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)R为Cl,单质Cl2的一种工业用途为制漂白粉(或制漂白液、用于自来水消毒等)。答案为:制漂白粉(或制漂白液、用于自来水消毒等);
(5)结合表中元素,可推得图中两种反应物为SO2和O2,产物为SO3,该转化过程的化学方程式为2SO2+O2![]() 2SO3。答案为:2SO2+O2
2SO3。答案为:2SO2+O2![]() 2SO3;
2SO3;
(6)科学家认为存在NH5这种物质,则其与水剧烈反应放出氢气,所得水溶液呈弱碱性,应为氨水,该反应的化学方程式为NH5+H2O=NH3.H2O+H2↑。答案为:NH5+H2O=NH3.H2O+H2↑。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下
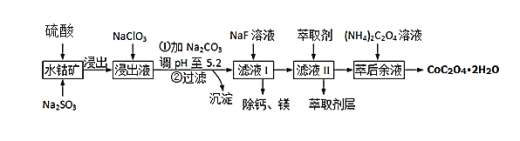
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
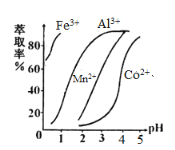
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。