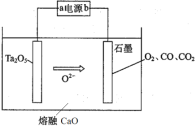
题目内容
【题目】(1)已知拆开1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1molNH3需要放出___kJ的热量。
(2)把0.2molX气体和0.4molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g);2min末生成0.3molW。若测知Z的浓度变化表示的反应速率为0.05mol/(Lmin)。计算:
①前2min内用Y的浓度变化表示的反应速率为___。
②化学方程式中n的值是___。
(3)某温度时在2L容器中A、B、C三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
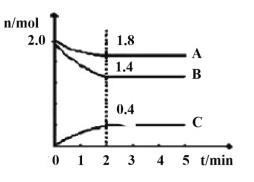
该反应的化学方程式为____。
下列叙述能说明上述反应达到平衡状态的是___。
A.混合气体的平均摩尔质量不随时间的变化而变化
B.相同时间内消耗2nmol的A的同时生成4nmol的C
C.混合气体的密度不随时间的变化而变化
D.容器内压强不再发生变化
【答案】46 0.0625mol/(Lmin) 4 A(g)+3B(g)![]() 2C(g) AD
2C(g) AD
【解析】
(1)拆1molH—H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2![]() 2NH3中,断裂3mol H—H键,1molN≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ;生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ;吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以生成1mol NH3放出热量为46kJ,故答案为:46;
2NH3中,断裂3mol H—H键,1molN≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ;生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ;吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,所以生成1mol NH3放出热量为46kJ,故答案为:46;
(2)由题干信息列三段式有:
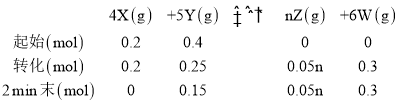
①前2min内用Y 的浓度变化表示的反应速率=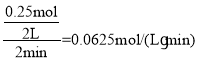 ,故答案为:0.0625mol/(L·min);
,故答案为:0.0625mol/(L·min);
②若测知Z的浓度变化表示的反应速率为0.05molL-1min-1,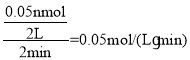 ,则n=4,故答案为:4;
,则n=4,故答案为:4;
(3)①2分钟内,A减少了2.0-1.8=0.2mol,B减少了2.0-1.4=0.6mol,C增加了0.4mol,则AB为反应物,C为生成物,三者物质的量的改变量的比等于系数比,方程式为A(g)+3B(g)![]() 2C(g),故答案为:A(g)+3B(g)
2C(g),故答案为:A(g)+3B(g)![]() 2C(g);
2C(g);
②A. 反应前后物质的量不同,所以总物质的量不随时间变化而变化说明反应到平衡,故正确;
B.消耗A和同时生成C都为正反应速率,故不能说明反应到平衡,故错误;
C.混合气体总质量不变,不能说明反应到平衡,故错误;
D.反应前后物质的量不同,故压强不变可以说明反应到平衡,故正确;
综上,AD正确,故答案为:AD。

【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
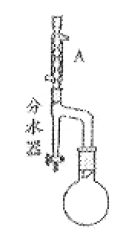
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。
分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05 g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79 g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95 g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是___。
(2)步骤2中,图中所示装置中仪器A的名称是___,其作用为___。
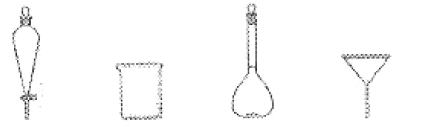
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是___;分离有机相的操作名称为__,分离有机相时不需要用到下列玻璃仪器中的__ (填名称)。
(4)实验中可能生成的有机副产物结构简式为____ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为___%。实际产率低于理论值的原因有多种,下列所述原因中不可能的是___ (填字母)。
a.分水器收集的水里含丙烯酸甲酯 b.本实验条件下发生了副反应
c.产品在洗涤、蒸发过程中有损失 d.产品精制时收集部分低沸点物质
(6)本实验中需要采取的安全防护措施有____。