题目内容
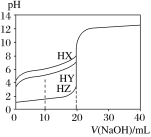
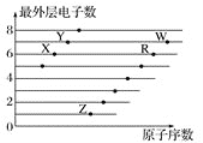
【题目】如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法不正确的是( )
A.氢化物沸点:H2X>H2R
B.含氧酸酸性:HWO>H2RO4
C.气态氢化物的稳定性:HY>HW>H2R
D.离子半径:R2->X2->Y->Z+
【答案】B
【解析】
由最外层电子数,可确定X、Y、Z、R、W分别为O、F、Na、S、Cl元素。
A.由于H2O分子间能形成氢键,而H2S分子间不能形成氢键,所以氢化物沸点:H2O>H2S,A正确;
B.虽然非金属性Cl>S,但由于HClO不是最高价含氧酸,其为弱酸,所以酸性:HClO<H2SO4,B不正确;
C.非金属性F>Cl>S,所以气态氢化物的稳定性:HF>HCl>H2S,C正确;
D.S2-电子层数最多,半径最大,O2-、F-、Na+的电子层结构相同,核电荷数依次增大,离子半径依次减小,所以离子半径:S2->O2->F->Na+,D正确;
故选B。

练习册系列答案
相关题目
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
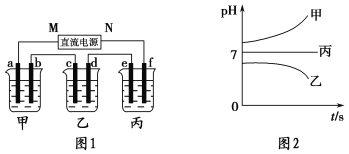
(1)M为直流电源的________极,b电极上发生的电极反应为______________________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应方程式:____________________________________________。