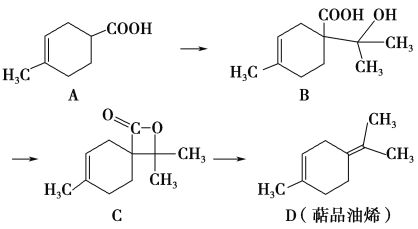
题目内容
【题目】为测定 K2[Cu(C2O4)2]·2H2O(M=354g/mol)含量,准确称取试样1.000g溶于 NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,重复试验,平均消耗 KMnO4标准液20.00mL。已知:C2O42-酸性条件下被MnO4-氧化为CO2,杂质不参加反应。该样品中K2[Cu(C2O4)2]·2H2O的质量分数为____________(保留小数点后两位) ,写出简要计算过程:__________________。
【答案】88.50% 根据电子得失新的可得关系式:4KMnO4~5K2[Cu(C2O4)2]2H2O,n(KMnO4)总=c·V= 0.01000 mol/L×0.02 L×![]() =2.0×10-3 mol,可得=n(K2[Cu(C2O4)2]·2H2O)=
=2.0×10-3 mol,可得=n(K2[Cu(C2O4)2]·2H2O)=![]() n(KMnO4)总=2.5×10-3 mol,m(K2[Cu(C2O4)2]·2H2O)=0.885 g,则该样品中K2[Cu(C2O4)2]·2H2O的质量分数为
n(KMnO4)总=2.5×10-3 mol,m(K2[Cu(C2O4)2]·2H2O)=0.885 g,则该样品中K2[Cu(C2O4)2]·2H2O的质量分数为![]() ×100%=88.50%
×100%=88.50%
【解析】
根据K2[Cu(C2O4)2]·2H2O具有还原性,而KMnO4具有氧化性,二者发生氧化还原反应,根据电子守恒,利用KMnO4的物质的量计算出样品中K2[Cu(C2O4)2]·2H2O的物质的量及质量,结合质量分数的含义计算其质量分数。
根据氧化还原反应中电子得失数目相等,可知K2[Cu(C2O4)2]·2H2O与KMnO4的物质的量关系式为:5K2[Cu(C2O4)2]·2H2O~4KMnO4,25.00mL K2[Cu(C2O4)2]·2H2O配成的溶液消耗KMnO4的物质的量为n(KMnO4)=c·V=0.01000mol/L×0.02 L=2.0×10-4mol,则250 mL这种溶液消耗KMnO4的总物质的量为n(KMnO4)总=2.0×10-4mol×![]() =2.0×10-3mol,则根据二者反应关系可知K2[Cu(C2O4)2]·2H2O的物质的量为n(K2[Cu(C2O4)2]·2H2O)=
=2.0×10-3mol,则根据二者反应关系可知K2[Cu(C2O4)2]·2H2O的物质的量为n(K2[Cu(C2O4)2]·2H2O)=![]() n(KMnO4)总=
n(KMnO4)总=![]() ×2.0×10-3mol=2.5×10-3mol,其质量为m(K2[Cu(C2O4)2]·2H2O)=n·M=2.5×10-3mol×354g/mol=0.885g,所以该样品中K2[Cu(C2O4)2]·2H2O的质量分数为
×2.0×10-3mol=2.5×10-3mol,其质量为m(K2[Cu(C2O4)2]·2H2O)=n·M=2.5×10-3mol×354g/mol=0.885g,所以该样品中K2[Cu(C2O4)2]·2H2O的质量分数为![]() ×100%=88.50%。
×100%=88.50%。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案