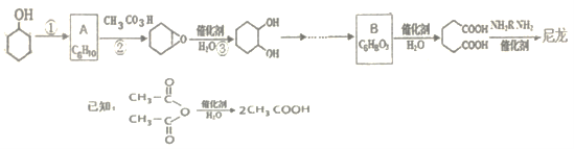
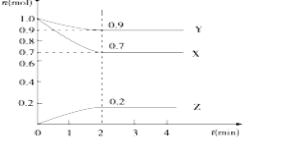
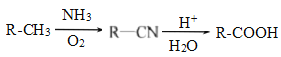题目内容
【题目】配制 100 mL 1.00 mol/L NaCl 溶液,下列说法正确的是( )
A.将所需量的 NaCl 溶于 100 mL 水中
B.将所需量的 NaCl 溶于少量水中,再加水定容到 100 mL
C.将所需量的 NaCl 直接放入容量瓶中,加水定容到 100 mL
D.定容时俯视读刻度
【答案】B
【解析】
根据题中配制100mL 1.00mol/L NaCl 溶液可知,本题考查一定物质的量浓度溶液的配置,根据![]() 和
和![]() 算出所需的氯化钠的质量,然后将所需要量的氯化钠,溶于水配成100ml溶液即可,注意100ml是指溶液的体积。
算出所需的氯化钠的质量,然后将所需要量的氯化钠,溶于水配成100ml溶液即可,注意100ml是指溶液的体积。
A.NaCl溶于100mL水中,溶液的体积大于100ml,所配溶液浓度偏小,故A错误;
B.根据浓度公式![]() ,将所需量的NaCl溶于少量水中,再加水定容到100mL,所得溶液的体积为100ml,所得溶液的浓度为1.00mol/L,故B正确;
,将所需量的NaCl溶于少量水中,再加水定容到100mL,所得溶液的体积为100ml,所得溶液的浓度为1.00mol/L,故B正确;
C.容量瓶为精密仪器,不能在容量瓶中稀释或者溶解物质,故C错误;
D.定容时应平视刻度线,如果俯视,则会导致加入的蒸馏水偏多,最终溶液的体积偏大,根据![]() 知最终配的溶液浓度偏小,故D错误;
知最终配的溶液浓度偏小,故D错误;
答案选B。

练习册系列答案
相关题目