题目内容
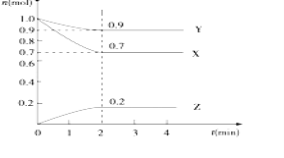
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。
请回答下列问题:
(1)由图中数据分析,该反应的化学方程式为__。
(2)反应开始至2min,Z的平均反应速率为__(列式计算,写出计算过程。)
(3)3min时,Z的生成速率与Z的消耗速率相比较,前者__(填“大于”“小于”或“等于”)后者。
(4)上述反应进行过程中,如果降低温度,则其反应速率___(填“增大”“减小”或“不变”)。
(5)下列各项中不可以说明上述反应达到平衡的是__(填字母)
a.混合气体的密度不变
b.混合气体的压强不变
c.同一物质的正反应速率等于逆反应速率
d.X的浓度保持不变
e.生成1molZ和同时生成1.5molX
f.X、Y、Z的反应速率之比为3:2:1
【答案】3X+Y![]() 2Z 0.05mol·L-1·min-1 等于 减小 af
2Z 0.05mol·L-1·min-1 等于 减小 af
【解析】
(1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到5min时,△n(Y)=0.1mol,△n(Z)=0.2mol,△n(X)=0.3mol,则△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X+Y2Z;
(2)反应开始至2min末,Z的反应速率为:v=![]() =
= =0.05mol·L-1·min-1;
=0.05mol·L-1·min-1;
(3)图象分析可知,反应到2min后,物质的量不再发生变化,说明反应达到平衡状态,所以3min后Z的生成速率和消耗速率相同;
(4)温度降低,单位体积内活化分子数会降低,分子运动速率会降低,有效碰撞频率会降低,化学反应速率会减小;
(5)a.气体质量和体积不变,无论该反应是否达到平衡状态,容器内密度始终不变,所以混合气体的密度不再变化不能判断平衡状态,故a错误;
b.该反应是一个反应前后气体体积减小的可逆反应,当容器内压强保持不变时,正逆反应速率相等,反应达到平衡状态,混合气体的压强不再变化说明反应达到平衡状态,故b正确;
c.同一物质的正反应速率等于逆反应速率说明达到化学平衡状态,故c正确;
d.各组分浓度不变达到化学平衡状态,所以X的浓度保持不变说明达到化学平衡状态,故d正确;
e.生成1molZ和同时生成1.5molX,说明正逆反应速率相等,即达到化学平衡状态,故e正确;
f.各组分反应速率之比等于其化学计量数之比,故X、Y、Z的反应速率之比为3:1:2,且与是否达到化学平衡状态无关,故f错误;
故答案为af。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】下列实验操作、解释或结论均正确的是
选项 | 实验目的 | 操作 | 结论或解释 |
A | 检验 | 取待测液少许,加入过量的 | 液体分层,加入硝酸酸化的 |
B | 检验某溶液中有无 | 取待测液少许,加入盐酸,有气体放出,将气体通入澄清石灰水中 | 澄清石灰水变浑浊,则含 |
C | 检验溶液中的 | 取待测液少许,先通入氯气,再加KSCN溶液 | 溶液变红色,则含 |
D | 检验食盐中是否含 | 取少量食盐溶于水,加少量淀粉 | 溶液变蓝色,则含 |
A.AB.BC.CD.D