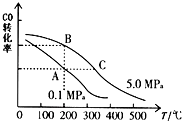
题目内容
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应
【答案】C
【解析】 解:A.酸和NaOH反应生成水,无明显现象,溶液为无色,但发生了复分解反应,故A错误;
B.反应生成硫酸钡沉淀和氯化铜,溶液为蓝色,白色沉淀为硫酸钡,故B错误;
C.发生Zn+2HCl=ZnCl2+H2↑,单质在离子反应中保留化学式,则离子反应为2H++Zn═Zn2++H2↑,故C正确;
D.Ⅲ中有离子参加反应,则属于离子反应,故D错误;
故选C.
A.酸和NaOH反应生成水,无明显现象,溶液为无色; B.反应生成硫酸钡沉淀; C.发生Zn+2HCl=ZnCl2+H2↑,单质在离子反应中保留化学式; D.Ⅲ中有离子参加反应.

【题目】根据题意解答
(1)某实验小组设计了下列实验以探究影响化学反应速率的因素. 实验I:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂,再分别放到如图所示的烧杯中水浴加热.实验发现,三支试管中产生气泡的速率不同.(洗涤剂起到将气体变为气泡的作用)
实验Ⅱ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂.在甲试管中加入MnO2少许,在乙试管中加入少许FeCl3 , 在丙中加入少许新鲜的鸡肝泥.观察到乙试管中产生气泡的速率最慢,而丙试管中产生气泡的速率最快.
实验Ⅲ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数分别为5%,10%和15%的过氧化氢溶液,各加入三滴洗涤剂,再分别滴加三滴浓FeCl3溶液.观察并记录实验现象.
实验Ⅳ:在甲、乙、丙三只相同的试管中分别加入少许鸡肝泥,再分别放到如图所示的烧杯中水浴加热2分钟,再分别向三支试管中加入5mL质量分数均为5%的过氧化氢溶液和三滴洗涤剂.观察到丙中产生气泡速率最慢.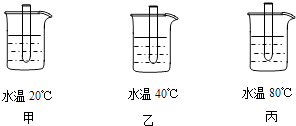
根据上述四个实验,回答下列问题:
①实验I的实验现象是 .
②实验Ⅱ的实验目的是 .
③实验Ⅲ的实验目的是;产生气泡速率最快的是试管(填“甲”“乙”或“丙”).
④实验Ⅳ中丙产生气泡速率最慢,该实验现象的原因可能是 .
(2)在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
时间 (s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
根据表格提供数据,请回答下列各小题:
①C1C2(填<,>或=).
②在0~20S内四氧化二氮的平均反应速度为 .
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 molL﹣1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 molL﹣1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 molL﹣1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ: .
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ . 已知:Cu+![]() Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+![]() CuI↓(白色)+I2 .
CuI↓(白色)+I2 .
①用稀硫酸证实沉淀中含有Cu+的实验现象是 .
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ . 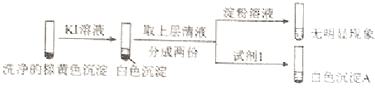
a.白色沉淀A是BaSO4 , 试剂1是 .
b.证实沉淀中含有Cu+和SO32﹣的理由是 .
(3)已知:Al2(SO3)3在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无SO42﹣ , 该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色.
①推测沉淀中含有亚硫酸根和 .
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中.对假设ii设计了对比实验,证实了假设ii成立.
a.将对比实验方案补充完整.
步骤一:
步骤二:(按图形式呈现).
b.假设ii成立的实验证据是
(4)根据实验,亚硫酸盐的性质有 . 盐溶液间反应的多样性与有关.