��Ŀ����
����Ŀ���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ش��������⣺
һ���¶��£���һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO��g��+2H2��g��CH3OH��g����H��0
��1���������β���˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.ÿ����1mol CO��ͬʱ����2molH2
B.������������ʵ�������
C.����CH3OH������������CO���������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��B��C�����ƽ�ⳣ��KB��KC�Ĵ�С��ϵΪ �� 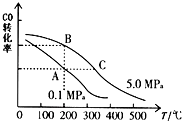
��3��ij�¶��£���2.0mol CO��6.0molH2����2L���ܱ������У��ﵽƽ��ʱ���c��CO��=0.25mol/L��CO��ת����= �� ���¶��µ�ƽ�ⳣ��K=��������λ��Ч���֣���
��4���¶�650���������ȼ�ϵ�أ��ã�CO��H2������Ӧ�������CO2�Ļ������Ϊ������Ӧ������缫����Li2CO3��Na2CO3�����������ʣ��õ�ص�������ӦʽΪ ��
��5����֪��CH3OH��H2��ȼ���ȣ���H���ֱ�Ϊ��726.5kJ/mol����285.8kJ/mol��������CO2��H2��Ӧ����CH3OH��H2O���Ȼ�ѧ����ʽ�� ��
���𰸡�
��1��C
��2��KB��KC
��3��75%��1.3
��4��O2+4e��+2CO2=2CO32��
��5��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJ?mol��1
���������⣺��1��A��ÿ����1mol CO��Ч������2molH2��ͬʱ����2molH2 �� ���淴Ӧ������ȣ���A��ȷ�� B��������������ʵ������䣬˵�������ʵ������䣬��Ӧ��ƽ��״̬����B��ȷ�� C������CH3OH������������CO��������ȣ������ֵ�����Ӧ����C���� D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯��˵�������ʵ������䣬��Ӧ��ƽ��״̬����D��ȷ����ѡ��C����2����B����A���¶���ͬ��K���䣬����������Ӧ�¶�����ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������A��B��C�����ƽ�ⳣ��KA=KB��KC �� ���Դ��ǣ�KB��KC����3����2.0mol CO��6.0mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.25mol/L����
CO��g��+ | 2H2��g���T | CH3OH��g�� | |
��ʼŨ�ȣ� | 1.0 | 3.0 | 0 |
�仯Ũ�ȣ� | 0.75 | 1.5 | 0.75 |
ƽ��Ũ�ȣ� | 0.25 | 1.5 | 0.75 |
CO��ת���� ![]() ��100%=75%�����¶��µĻ�ѧƽ�ⳣ��K=
��100%=75%�����¶��µĻ�ѧƽ�ⳣ��K= ![]() =
= ![]() ��1.3�����Դ��ǣ�75%��1.3����4�������������õ��ӺͶ�����̼��Ӧ����̼������Ӷ�������ԭ��Ӧ���缫��ӦʽΪ��O2+4e��+2CO2=2CO32�� �� ���Դ��ǣ�O2+4e��+2CO2=2CO32������5����H2��g����ȼ���ȡ�HΪ��285.8kJmol��1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ������H2��g��+
��1.3�����Դ��ǣ�75%��1.3����4�������������õ��ӺͶ�����̼��Ӧ����̼������Ӷ�������ԭ��Ӧ���缫��ӦʽΪ��O2+4e��+2CO2=2CO32�� �� ���Դ��ǣ�O2+4e��+2CO2=2CO32������5����H2��g����ȼ���ȡ�HΪ��285.8kJmol��1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ������H2��g��+ ![]() O2��g��=H2O��l����H=��285.8kJmol��1����CH3OH��l��+
O2��g��=H2O��l����H=��285.8kJmol��1����CH3OH��l��+ ![]() O2��g��=CO2��g��+2 H2O��l����H=��726.5kJmol��1 �� �ɸ�˹���ɿ�֪��3���٩��ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 �� ���Դ��ǣ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 ��
O2��g��=CO2��g��+2 H2O��l����H=��726.5kJmol��1 �� �ɸ�˹���ɿ�֪��3���٩��ڵ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 �� ���Դ��ǣ�CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=��130.9 kJmol��1 ��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���жϵ����֪ʶ������״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

����Ŀ��ijͬѧ��ʵ�����н�������ʵ�飺
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | û�����Ա仯����Һ��Ϊ��ɫ | �а�ɫ�������ɣ���ҺΪ��ɫ | ����ɫ����ų� |
���½�����ȷ���ǣ� ��
A.���������Ա仯��˵������Һ����Ӧ
B.���еİ�ɫ����ΪCuCl2
C.���е����ӷ���ʽΪ2H++Zn�TZn2++H2��
D.���з����ķ�Ӧ�������ӷ�Ӧ







