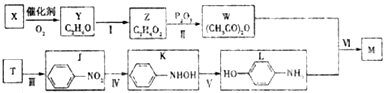
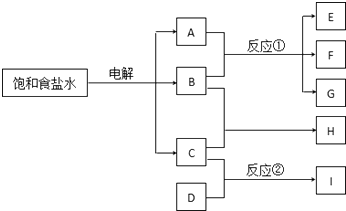
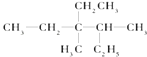
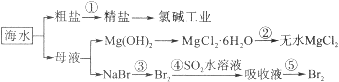
题目内容
【题目】常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。下列叙述正确的是( ) 
A.所用盐酸的浓度是0.09mol·L─1 , NaOH溶液浓度为0.03mol·L─1
B.在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+)
C.A,B,C三点水的电离程度大小依次为:A>B>C
D.滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低
【答案】A
【解析】结合图像,假设HCl的浓度是x mol·L─1 , NaOH溶液浓度为y mol·L─1 , 有:20×10─3×x=60×10─3×y , ─lg( 20×10─3×x─40×10─3×y(20+40 )=2;解得:x=0.09,y=0.03,A项正确;B点,溶液显酸性, c(H+)>c(OH_),B项错误;A、B、C三点酸性依次减弱,水电离程度逐渐增大,C项错误;滴定前,锥形瓶用待测液润洗,增加n(H+),消耗n(NaOH)增大,导致盐酸浓度偏高,D项错误。
【考点精析】本题主要考查了酸碱中和滴定的相关知识点,需要掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点才能正确解答此题.

【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应