题目内容
【题目】根据题意解答
(1)某实验小组设计了下列实验以探究影响化学反应速率的因素. 实验I:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂,再分别放到如图所示的烧杯中水浴加热.实验发现,三支试管中产生气泡的速率不同.(洗涤剂起到将气体变为气泡的作用)
实验Ⅱ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂.在甲试管中加入MnO2少许,在乙试管中加入少许FeCl3 , 在丙中加入少许新鲜的鸡肝泥.观察到乙试管中产生气泡的速率最慢,而丙试管中产生气泡的速率最快.
实验Ⅲ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数分别为5%,10%和15%的过氧化氢溶液,各加入三滴洗涤剂,再分别滴加三滴浓FeCl3溶液.观察并记录实验现象.
实验Ⅳ:在甲、乙、丙三只相同的试管中分别加入少许鸡肝泥,再分别放到如图所示的烧杯中水浴加热2分钟,再分别向三支试管中加入5mL质量分数均为5%的过氧化氢溶液和三滴洗涤剂.观察到丙中产生气泡速率最慢.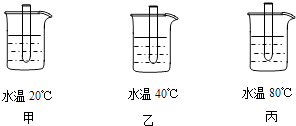
根据上述四个实验,回答下列问题:
①实验I的实验现象是 .
②实验Ⅱ的实验目的是 .
③实验Ⅲ的实验目的是;产生气泡速率最快的是试管(填“甲”“乙”或“丙”).
④实验Ⅳ中丙产生气泡速率最慢,该实验现象的原因可能是 .
(2)在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
时间 (s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
根据表格提供数据,请回答下列各小题:
①C1C2(填<,>或=).
②在0~20S内四氧化二氮的平均反应速度为 .
【答案】
(1)丙中产生气泡速率最快,甲中最慢;探究MnO2、FeCl3和鸡肝泥三种催化剂对反应速率的影响大小;探究浓度对反应速率的影响;丙;在80℃时,鸡肝泥失去或降低了催化效率
(2)<;0.003mol/(L?s).1
【解析】解:(1)①根据实验I中甲、乙、丙反应条件可知,实验I探究的是温度对反应速率的影响,温度越高,反应速率越快,所以答案是:丙中产生气泡速率最快,甲中最慢;②实验Ⅱ中在甲、乙、丙三只相同的试管中分别加入不同的催化剂,探究是不同催化剂对反应速率的影响大小,所以答案是:探究MnO2、FeCl3和鸡肝泥三种催化剂对反应速率的影响大小;③实验Ⅲ中在甲、乙、丙三只相同的试管中分别加入不同浓度的过氧化氢溶液,探究的是浓度对反应速率的影响,所以答案是:探究浓度对反应速率的影响;④温度较高时酶会失去活性,催化效率降低,所以答案是:在80℃时,鸡肝泥失去或降低了催化效率;(2)①依据图表数据分析,发生的反应为N2O42NO2 , 40s时C(N2O4)=0.10molL﹣1 , △c(NO2)=2△c(N2O4)=0.20molL﹣1 , 则C2=0.20molL﹣1 , 而根据表格0.10molL﹣1<C1<0.20molL﹣1 , 故C1<C2 , 所以答案是:<; ②进行到20s;
N2O4 | 2NO2 | ||
起始量(mol/L) | 0.20 | 0 | |
变化量(mol/L) | 0.06 | 0.12 | |
20S末(mol/L) | 0.14 | 0.12 |
20s时,N2O4的浓度=C1=0.14mol/L;
0~20s内N2O4的平均反应速率= ![]() =0.003mol/(Ls),
=0.003mol/(Ls),
所以答案是:0.003mol/(Ls).

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应