��Ŀ����
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԣ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 molL��1 Na2SO3��Һ | ����Ag2SO4��Һ | ������ɫ���� |
0.2 molL��1 CuSO4 | ����Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 molL��1 Al2��SO4��3��Һ | ��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬������еİ�ɫ������Ag2SO3 �� �����ӷ���ʽ��������� ��
��2�������飬�������ػ�ɫ�����в���SO42�� �� ����Cu+��Cu2+��SO32�� �� ��֪��Cu+![]() Cu+Cu2+ �� Cu2+
Cu+Cu2+ �� Cu2+![]() CuI������ɫ��+I2 ��
CuI������ɫ��+I2 ��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32�� �� 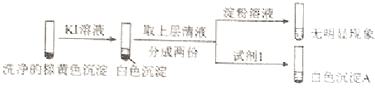
a����ɫ����A��BaSO4 �� �Լ�1�� ��
b��֤ʵ�����к���Cu+��SO32���������� ��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڣ������飬�����İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�ڶ��ڳ�������������Ĵ�����ʽ������ּ��裺i����Al��OH��3��������ii�����������ļ�ʽ���У��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a�����Ա�ʵ�鷽������������
����һ��
�����������ͼ��ʽ���֣���
b������ii������ʵ��֤����
��4������ʵ�飬�������ε������� �� ����Һ�䷴Ӧ�Ķ��������йأ�
���𰸡�
��1��2Ag++SO32��=Ag2SO3��
��2���к�ɫ�������ɣ�Ba��OH��2��Һ���ػ�ɫ������KI��Һ��Ӧ���ɰ�ɫ������CuI����֤������Cu2+ �� ��ɫ����AΪ���ᱵ��֤������SO32��
��3������������ ��V1=V2
��V1=V2
��4����ԭ�ԡ�ˮ��ʼ��ԣ��ε����ʺ���Һ�������
���������⣺��1��ʵ�����0.2mol/LNa2SO3��Һ���뱥��Ag2SO4��Һ������Ӧ���ɰ�ɫ����Ag2SO3 �� ��Ӧ�����ӷ���ʽΪ��2Ag++SO32��=Ag2SO3�����ʴ�Ϊ��2Ag++SO32��=Ag2SO3������2�������ݷ�ӦCu+��ϡ���ᷴӦͭ��ͭ���ӣ��������к���Cu+ �� ����ϡ����ᷢ���绯��Ӧ����ͭ���ʣ�ʵ���������к�ɫ�������ɣ�
�ʴ�Ϊ���к�ɫ�������ɣ�
��a������ʵ�����̿�֪ʵ��ԭ��Ϊ2Cu2++4I��=2CuI+I2��I2+SO32��+H2O=SO42��+2I��+2H+��SO42��+Ba2+=BaSO4�������� BaSO4������֪��������Լ�Ϊ��Ba2+�Ļ��������ѡ��BaCl2����Ba��OH��2 �� ���� OH���������ڼ��� Cu2+ �� ����ѡ�� Ba��OH��2��Һ��
�ʴ�Ϊ��Ba��OH��2��Һ��
b��֤ʵ�����к���Cu+��SO32�����������ػ�ɫ������KI��Һ��Ӧ���ɰ�ɫ������CuI����֤������Cu+ �� ��ɫ����AΪ���ᱵ��֤������SO32�� ��
�ʴ�Ϊ���ػ�ɫ������KI��Һ��Ӧ���ɰ�ɫ������CuI����֤������Cu2+ �� ��ɫ����AΪ���ᱵ��֤������SO32������3���ٸ�������֪ʵ���İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ���Ʋ�����к����������������������
�ʴ�Ϊ������������
��a������� Al��OH��3 �� ���ļ�ʽ�������е�������ÿ������Ӧ�����������Ӳ�������������¼������������������Һ����� V1 �� ����˼·�����ж��֣�����ʹ��ͬŨ�ȵ���ȥ������Ȼ�����в�δ�ṩ���õ�ϡ NaOH ��Ũ�ȣ������ƽ�бȽϣ�����˱����ظ�ʹ����������ϡ NaOH ��Һ����ƽ��ʵ�飮�������ʵ�鷽����Ʋ����Ϊ��  �� �ʴ�Ϊ��
�� �ʴ�Ϊ��  ��
��
b������ii������ʵ��֤����V1=V2 ��
�ʴ�Ϊ��V1=V2����4����Ŀ���жദ��ʾ���ǻ�ԭ�ԣ����磨3���еij�������ʹ���Ը��������ɫ���ڶ��գ�ʵ�����Ҫ����ʵ��Ŀ�ģ�������Ŀ������̽������ Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ӧ�����Եõ����ۣ�����Һ�䷴Ӧ�Ķ������벻ͬ�����������йأ���Ҫ���ε����ʺ���Һ������ԣ�
�ʴ�Ϊ����ԭ�ԡ�ˮ��ʼ��ԣ��ε����ʺ���Һ������ԣ�
��1��0.2mol/LNa2SO3��Һ���뱥��Ag2SO4��Һ������Ӧ���ɰ�ɫ����Ag2SO3����2���ٸ��ݵڶ��������� 2 ����֪��Ϣ�����Ե�֪��ȡ����ϴ�����ų� Cu2+���ţ����ػ�ɫ �������μ�ϡ���ᣬ������죨ͭ���ʣ�����֤���� Cu+����a������ BaSO4������֪��������Լ�Ϊ��Ba2+�Ļ��������ѡ��BaCl2����Ba��OH��2 �� ���� OH���������ڼ��� Cu2+ �� ����ѡ�� Ba��OH��2��
b���ɰ�ɫ���� A ��֪֮ǰ��ȡ�ϲ���Һ���� SO42�� �� �ɼ��� KI ���ɰ�ɫ������֪�� Cu+ �� �ɼӵ���������˵���� I2 �� ����л�ԭ�� SO32������3���������⣬��ɫ������������ǿ�ᣬ��������ǿ����Եõ������к��� Al��OH��3��������� Al��OH��3 �� ���ļ�ʽ�������е�������ÿ������Ӧ�����������Ӳ��������������Ӧ�����һ������ʵ�飬��¼������������������Һ����� V1 �� ����˼·�����ж��֣�����ʹ��ͬŨ�ȵ���ȥ������Ȼ�����в�δ�ṩ���õ�ϡ NaOH ��Ũ�ȣ������ƽ�бȽϣ�����˱����ظ�ʹ����������ϡ NaOH ��Һ����ƽ��ʵ�飮ʵ����������ʾ����4������ʵ�飬�������ξ��л�ԭ�ԡ�ˮ��ʼ��ԣ�����Һ�䷴Ӧ�Ķ��������ε����ʺ���Һ��������йأ����⿼�黯ѧʵ�鷽���ķ��������ۺ���ƣ���Ҫ�����Ӽ����ʵ����̵�����Ӧ�ã���Ŀ�ѶȽϴ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijͬѧ��ʵ�����н�������ʵ�飺
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | û�����Ա仯����Һ��Ϊ��ɫ | �а�ɫ�������ɣ���ҺΪ��ɫ | ����ɫ����ų� |
���½�����ȷ���ǣ� ��
A.���������Ա仯��˵������Һ����Ӧ
B.���еİ�ɫ����ΪCuCl2
C.���е����ӷ���ʽΪ2H++Zn�TZn2++H2��
D.���з����ķ�Ӧ�������ӷ�Ӧ
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⡣
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
������/kJ��mol��1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
Aͨ�����ۣ�BԪ�صĺ�������Ų�ʽΪ��
��2������Ϊ300nm�����Ĺ��������е�����ԼΪ399 kJ��mol��1�������±��йص����ʷ�������Ҫ��ѧ������Ϣ��˵�����峤ʱ������������Ƥ�������˺���ԭ��������ɵ����ʵ���İ������е�̼ԭ���ӻ���������
���ۼ� | C��C | C��N | C��S |
����/ kJ��mol��1 | 347 | 305 | 259 |
��3��ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ
��NaCl����ṹ���ƣ�����ͼ��ʾ������֪3�����Ӿ���ľ������������±���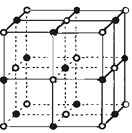
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol��1 | 786 | 715 | 3401 |
���4�����Ӿ��壨������NaCl���۵�Ӹߵ��͵�˳����������MgO������һ��Mg2����Χ�������ڽ��ҵȾ����Mg2��������
��4�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ�����
��5��ij�����ķ��ӽṹ����ͼ��ʾ��������ڲ�����������ţ���
A.���Ӽ�
B.���Լ�
C.������
D.���
E.���
F.�Ǽ��Լ�