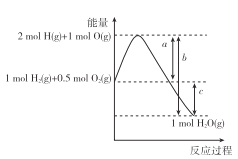
��Ŀ����
����Ŀ����֪��ɫ��ҺX���ܺ���H+��Na+��NH4+��Mg2+��Al3+��CO32-��NO3-��SO42-�еļ������ӣ�ij��ѧ��ȤС��ͨ������ʵ��ȷ������ɷ�(���������Լ������������������ת��Ϊ��״��)��
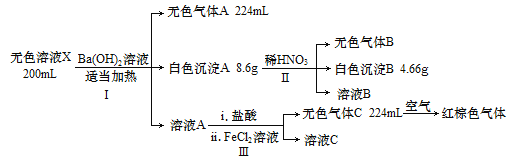
�ش��������⣺
(1)ʵ����ȷ����ɫ��ҺX��һ�������ڵ�������________��
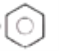
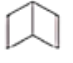
(2)��ɫ����A�Ŀռ乹��Ϊ_______����ɫ����A�ijɷ�Ϊ_______(д��ѧʽ)��
(3)ʵ����еĵ�ii��������Ӧ�����ķ�Ӧ�����ӷ���ʽΪ________��
(4)����ɫ��ҺX��һ�����ڵ������Ӽ������ʵ���Ũ��Ϊ________��
���𰸡�H+��Mg2+��Al3+ ������ BaCO3��BaSO4 3Fe2++4H++NO3-=3Fe3++NO��+2H2O c(NH4+)=0.05mol/L��c(Na+)=0.4mol/L
��������
��ɫ��ҺX�м���Ba(OH)2��Һ���Ȳ�����ɫ����A��NH3��˵������NH4+�����ݰ��������ʵ����ɼ����NH4+�����ʵ�����ͬʱ������ɫ����A����ó����м���ϡ���������ɫ����B��ͬʱ�а�ɫ����B��˵������A��BaSO4��BaCO3�Ļ������ߵ�������Ϊ8.6g������B��BaSO4������B��CO2��˵��ԭ��Һ�к�SO42-��CO32-�����ݳ���A��B�������ɼ����ԭ��Һ�к��е�SO42-��CO32-�����ʵ���������ҺA�м��������ữ��������FeCl2��Һ��������ɫ����C���������������Ϊ����ɫ����B��NO��˵��III������������ԭ��Ӧ��A�к���NO3-������NO����������NԪ���غ�ɵ�NO3-�����ʵ������������ӹ����ж��Ƿ����������ӣ������з������
��������������֪������Һ��һ������NH4+��SO42-��CO32-��NO3-������CO32-��H+��Mg2+��Al3+�ᷢ�����ӷ�Ӧ�����ܴ������棬���Ը���Һ��һ��������H+��Mg2+��Al3+���ӣ�
(2)��ɫ����A��NH3����������ӳ������Σ���ɫ����A��BaSO4��BaCO3�Ļ���
(3) ʵ����еĵ�ii��������H+��NO3-��Fe2+����������ԭ��Ӧ�����ݵ����غ㡢����غ㼰ԭ���غ㡣�ɵø÷�Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3-=3Fe3++NO��+2H2O��
(4)�������������������֪��Ϣ�����Ԫ���غ��֪����ԭ��Һ�к��е����ӵ����ʵ����ֱ��ǣ�n(NH4+)=n(NH3)=0.224L��22.4L/mol=0.01mol��n(SO42-)=n(BaSO4)=4.66g��233g/mol=0.02mol��n(CO32-)=n(BaCO3)=(8.6-4.66)g��197g/mol=0.02mol��n(NO3-)=n(NO)= 0.224L��22.4L/mol=0.01mol�������Ӵ��еĸ�����������������Ӵ��е������������������Һ�ʵ����ԣ�˵����Һ�л�����������Na+�������ʵ�����n(Na+)=2n(SO42-)+2n(CO32-)+n(NO3-)- n(NH4+)=2��0.02mol+2��0.02mol+0.01mol-0.01mol=0.08mol����Һ�������200mL�������ɫ��ҺX��һ�����ڵ������ӵ����ʵ���Ũ��c(NH4+)= n(NH4+)��V=0.01mol��0.2L=0.05mol/L��c(Na+)= n(Na+)��V=0.08mol��0.2L=0.4mol/L��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʵ���������������۶�Ӧ��ϵ��ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ͬ�¶��£�ͬʱ�� ��4 mL 0.1 molL-1 KMnO4������Һ����4 mL 0.2 molL-1 KMnO4������Һ�У��ֱ����4 mL 1 molL-1 H2C2O4��Һ | ������Һ����ɫ | ��ʵ�������£�KMnO4Ũ��ԽС����Ӧ����Խ�� |
B | ��ú¯�����ȵ�ú̿��������ˮ | ��������ɫ���棬ú̿ȼ�ո��� | ������ˮ��ʹú̿ȼ�շų���������� |
C | ����2NO2(g) | ��ɫ���� | ֤������Ӧ�Ƿ��ȷ�Ӧ |
D | �ֱ�ⶨ�����µ����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH | ���߽ϴ� | ֤���ǽ����� S��C |
A.AB.BC.CD.D